細胞極性確立和極性生長是細胞成熟和分化過程中的自然現象。在牙髓組織、神經組織等的分化和形成過程中,干細胞通過細胞骨架的動態組裝與定向作用進行有規律的極性生長,從而實現其在不同組織和器官中的功能化。微絲(肌動蛋白)細胞骨架在控制細胞極性建立和細胞極性生長過程中發揮關鍵作用,但目前通過超分子手段調控微絲極性進而調節細胞極性的研究尚未見報道。
基于人工調控細胞極性的設想,南開大學劉育教授團隊利用功能化高分子鏈修飾的磁性納米粒子與環糊精修飾的透明質酸(HACD)進行超分子組裝(圖1),將組裝體引入到細胞體系當中,成功實現了磁場誘導下的定向細胞極性確立和極性延伸。
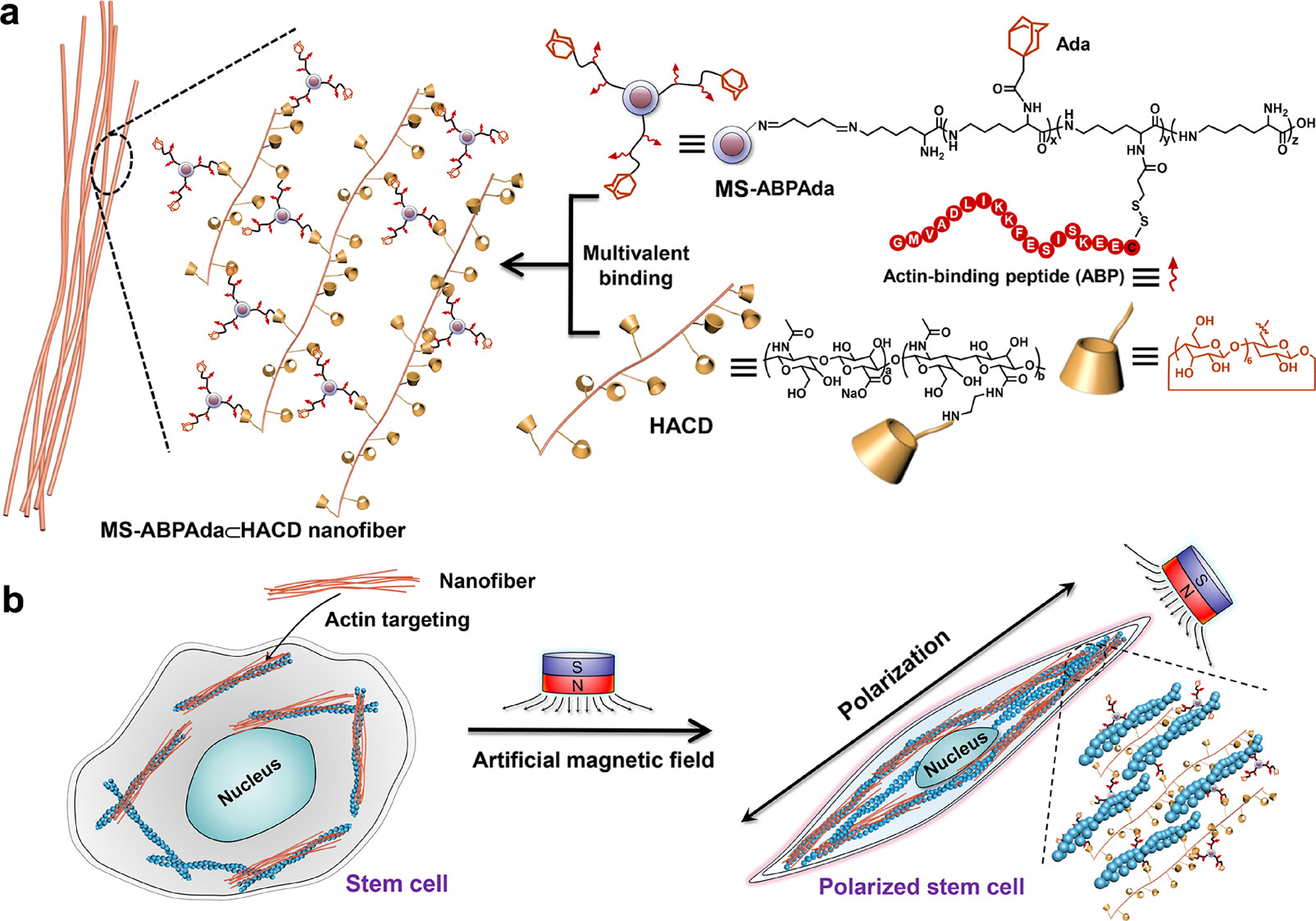
圖1. MS-ABPAda?HACD 納米組裝體的構筑(a)及其介導的細胞極性調控(b)
在該工作中,作者首先對聚賴氨酸修飾的磁性納米粒子進行功能化衍生。一方面,在聚賴氨酸鏈上共價修飾肌動蛋白靶向肽,使磁性納米粒子具有肌動蛋白靶向能力;另一方面,在該鏈上共價修飾疏水性客體金剛烷,便于磁性納米粒子與環糊精等主體分子進行超分子組裝(圖1)。當該功能化磁性納米粒子(MS-ABPAda)與牙髓干細胞進行共同孵育時,由于肌動蛋白靶向肽的存在,磁性納米粒子能夠高效靶向細胞內的肌動蛋白。

圖2. 人工定向磁場誘導下形成的MS-ABPAda?HACD納米纖維組裝體。(a)納米纖維電子顯微鏡圖;(b)納米纖維光學顯微鏡圖;(c)納米纖維組裝體形成的速度與磁場強度的相關性。
在上述修飾的磁性納米粒子基礎上進一步引入環糊精修飾的多糖高分子鏈(環糊精修飾的透明質酸,HACD)。由于金剛烷分子與環糊精之間的強親疏水鍵合作用,該組裝體在體外可沿磁場方向形成超分子納米纖維(MS-ABPAda?HACD),并且納米纖維的生長速度與磁場強度呈正相關(圖2)。在定向磁場條件下,該組裝體首先發生解組裝并通過內吞作用進入細胞,隨后在細胞內靶向肌動蛋白細胞骨架并重新定向組裝成納米纖維。有趣的是,納米纖維能夠誘導肌動蛋白沿磁場方向發生重新定向,進而導致細胞沿磁場方向確立極性(圖3)。

圖3. 定向磁場條件下,MS-ABPAda?HACD組裝體通過內吞作用進入細胞并誘導細胞的極性重構
該工作不僅首次通過功能化超分子組裝體實現了對細胞極性的調控,而且為體外精準調控細胞行為提供了新的思路。
以上成果發表在ACS Applied Materials & Interfaces (2021, DOI:10.1021/acsami.0c19428)上。論文的第一作者為南開大學化學學院博士后張冰,通訊作者為劉育教授。
原文鏈接:
https://doi.org/10.1021/acsami.0c19428
- 二十余載深耕|北京大學范星河教授編著新書《聚合物鏈超分子組裝與功能化: 甲殼型液晶聚合物》出版 2025-01-14
- 同濟大學劉國鋒、南洋理工大學趙彥利院士 Nat. Commun.:超分子組裝體的動態手性反轉 2024-11-14
- 陜科大王學川、劉新華、岳歐陽等 Nano Today:基于超分子相互作用的形狀適應水下粘合材料 2024-04-24
- 四川大學高會樂教授和成果教授 Small:一種鼻腔給藥的腦靶向納米遞藥系統用于阿爾茨海默病的聯合治療 2022-07-06
- 浙江海洋大學歐陽小琨教授課題組《Carbohyd. Polym.》:用于快速止血和促進傷口愈合的納晶纖維素/海藻酸鈣多孔微球 2022-06-26
- 天津大學趙燕軍教授團隊 AFM: 用于鐵死亡增敏的機械力應答聚合物 2022-04-29
- 武漢大學張先正教授團隊 ACS Nano:陽離子磁性納米粒子激活自然殺傷細胞用于治療膠質母細胞瘤 2024-12-28
