癌癥仍然威脅著人類的健康,近年來腫瘤免疫治療得到了廣泛的關(guān)注。這種療法通過刺激宿主免疫系統(tǒng)來對抗癌癥,恢復(fù)抗腫瘤免疫功能。然而低反應(yīng)率和副作用等限制了其進一步廣泛應(yīng)用。生物材料特別是水凝膠材料在增效腫瘤免疫治療發(fā)面有著巨大的潛力。
近日,蘇州大學(xué)汪超教授團隊利用生理學(xué)觸發(fā)形成的紅細胞凝膠用于癌癥的光免疫治療。研究者發(fā)現(xiàn)皮下注射紅細胞后可在短時間內(nèi)由血小板、凝血酶等生理信號觸發(fā)形成紅細胞凝膠。此外,作者意外的發(fā)現(xiàn),由于紅細胞凝膠的深紅色特點,紅細胞凝膠可在近紅外光照下升溫。因此作者將免疫佐劑咪喹莫特(R837)與紅細胞通過疏水相互作用裝載到紅細胞磷脂雙層膜中,通過瘤內(nèi)注射,利用808nm近紅外光進行治療。
首先作者利用掃描電鏡及凝膠的流變性能證明了紅細胞凝膠在體內(nèi)的形成,其次利用共聚焦結(jié)果證實了紅細胞凝膠的形成是由于體內(nèi)血小板、凝血酶等生理信號的觸發(fā)。通過光熱后淋巴結(jié)處熒光信號增強,表明局部注射后光照促使藥物釋放,遷移至腫瘤附近的引流淋巴結(jié)。淋巴結(jié)的免疫細胞流式分析結(jié)果表明激光治療促進了R837釋放到附近的淋巴結(jié),并誘導(dǎo)大量免疫細胞特別是抗原呈遞細胞的激活。
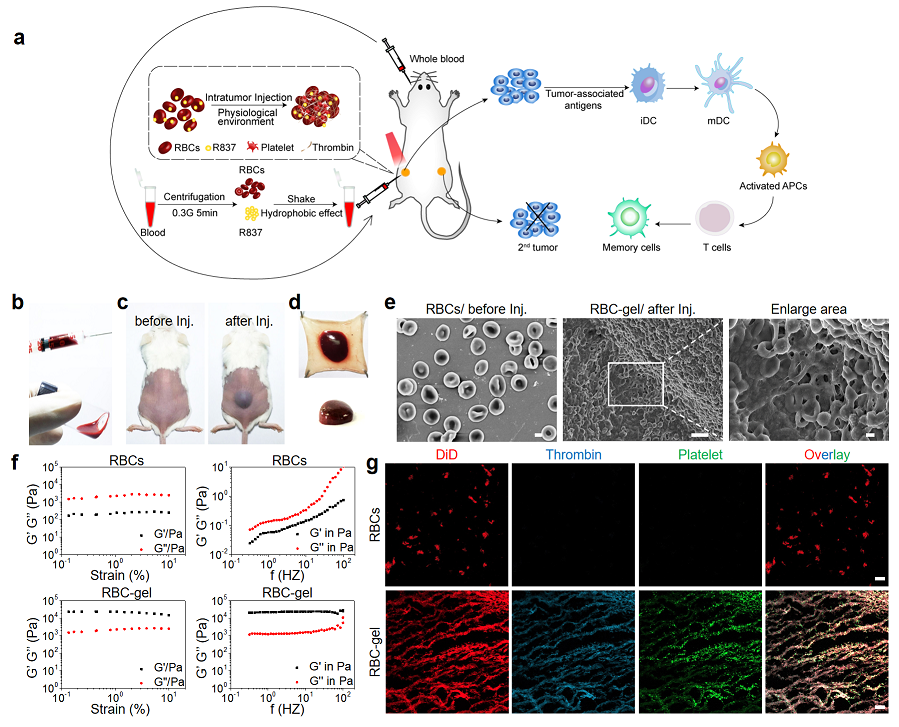
圖1: a)紅細胞凝膠聯(lián)合免疫佐劑R837的光免疫治療獲得全身治療應(yīng)答的機制, b)注射前流動態(tài)的紅細胞, c)皮下注射紅細胞前后, d)5分鐘后紅細胞凝膠在皮膚下形成, e)紅細胞及紅細胞凝膠的掃描電鏡圖像, f)紅細胞及紅細胞凝膠的彈性(G’)模和粘性(G”)模的應(yīng)變和頻譜, g)紅細胞及紅細胞凝膠的共聚焦熒光圖像。

圖2:a)皮下注射的紅細胞在近紅外激光照射方案說明, b) 注射PBS或紅細胞的小鼠在808 nm激光照射下的熱成像圖, c)150 μL PBS和紅細胞在不同激光強度下的升溫曲線, d)不同溫度下紅細胞凝膠中的藥物釋放, e)紅細胞和紅細胞(L+)共聚焦熒光圖像, f)淋巴結(jié)熒光成像, g)熒光染料對應(yīng)的定量平均熒光強度(MFI)在淋巴結(jié)中的表達, h)淋巴結(jié)中DiD陽性細胞的百分比, i)淋巴結(jié)共聚焦熒光圖像, j)淋巴結(jié)中巨噬細胞的百分比, k-l)R837@RBCs或R837@RBCs (L+)處理后后巨噬細胞的表達, m)淋巴結(jié)中樹突狀細胞的百分比, n-o)R837@RBCs或R837@RBCs (L+)處理后樹突狀細胞的表達。
在皮下結(jié)腸癌模型中證實了R837@RBCs結(jié)合光熱治療具有明顯的抗腫瘤效果,小鼠血清中TNF-α和IFN-γ的濃度顯著升高,此外,該實驗組的小鼠中,CD8+和CD4+ T細胞的比例和數(shù)量也明顯增加。為了進一步研究免疫反應(yīng)的特異性、功能性和持久性,第44天在所有存活的小鼠另一邊再次接種同源CT26癌細胞。結(jié)果清楚地證明了免疫佐劑R837在小鼠中產(chǎn)生的長期免疫記憶效應(yīng)可以保護腫瘤的復(fù)發(fā)。流式結(jié)果和Elisa結(jié)果表明成功激活抗腫瘤免疫記憶反應(yīng),有效預(yù)防腫瘤復(fù)發(fā)。此外,R837@RBCs結(jié)合光熱治療也能預(yù)防遠端腫瘤的生長。
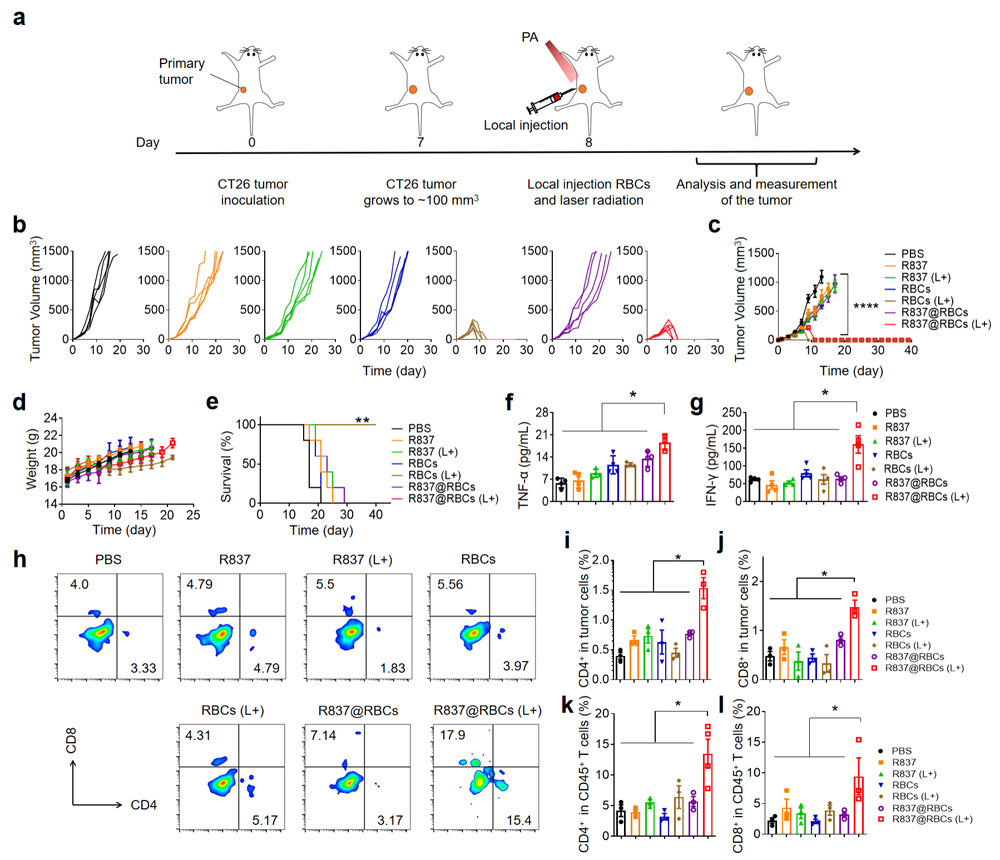
圖3:a) R837@RBC結(jié)合 PTT抑制腫瘤生長治療示意圖, b)單個腫瘤生長動力學(xué), c)不同治療后各組平均腫瘤生長曲線, d)對照組和治療組小鼠體重測定, e)不同處理的生存曲線, f-g)不同處理后第7天分離的小鼠血清細胞因子水平, h)腫瘤浸潤T細胞的代表性流式細胞術(shù)分析, i)腫瘤中CD4+ T細胞百分比的定量, j)腫瘤中CD8+ T細胞百分比的定量, k-l)腫瘤浸潤T細胞CD4+占CD45+ T細胞的比例,CD8+占CD45+ T細胞的比例。
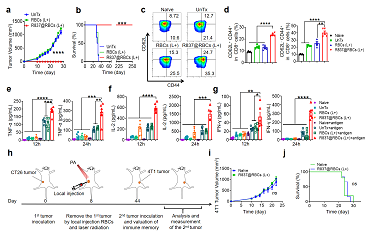
圖4:a-b)第一次切除腫瘤后74天再接種的腫瘤生長曲線和存活率, c)具有代表性的流式細胞術(shù)分析和定量分析, d)Tcm和Tem在脾臟中的百分比, e-g)在體外加入腫瘤裂解液(抗原)再刺激脾細胞后TNF-α,IL-2, IFN-γ的分泌水平, h)接種CT26的小鼠再挑戰(zhàn)4T1, i)腫瘤生長曲線和j)再挑戰(zhàn)腫瘤生存率。
相關(guān)成果以”Physiologically Triggered Injectable Red Blood Cell-Based Gel for Tumor Photoablation and Enhanced Cancer Immunotherapy”為題發(fā)表在Biomaterials上。論文的第一作者為蘇州大學(xué)功能納米與軟物質(zhì)研究院碩士研究生費姿穎,通訊作者為蘇州大學(xué)汪超教授,共同通訊作者為東京工業(yè)大學(xué)Atsushi Maruyama教授與蘇州大學(xué)功能納米與軟物質(zhì)研究院范親博士。
原文鏈接:https://www.sciencedirect.com/science/article/abs/pii/S0142961221000764
- 西南林大杜官本教授、楊龍研究員團隊 Nat. Commun.:碳化聚合物點誘導(dǎo)結(jié)晶域集成取向調(diào)控構(gòu)建強健和堅韌水凝膠 2025-07-07
- 中山大學(xué)吳丁財/黃榕康/鄭冰娜/王輝團隊 Adv. Mater.:具有長駐留性的可注射多孔炭納米酶水凝膠實現(xiàn)腫瘤的協(xié)同治療 2025-07-04
- 重醫(yī)大毛翔團隊、哈工大賀良燦團隊 Small 綜述:復(fù)合水凝膠的創(chuàng)新與應(yīng)用-從聚合物體系到摻金屬離子和功能性納米材料增強型結(jié)構(gòu) 2025-07-04
- 常州大學(xué)王建浩教授團隊《Acta Biomater.》:藥物儲庫型聚合物納米膠束用于腫瘤長效治療的研究成果 2025-07-08
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現(xiàn)精準光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團隊 Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
