在體細(xì)胞生活在一定的微環(huán)境中,微環(huán)境中多種信號(包括物理、化學(xué)信號)起到維持細(xì)胞正常形態(tài)功能的作用。越來越多的研究表明,機體發(fā)育、疾病的發(fā)生發(fā)展等生理病理過程與細(xì)胞及其力學(xué)微環(huán)境(mechanical microenvironment)的變化密切相關(guān)。細(xì)胞微環(huán)境中的多種力學(xué)信號(如基質(zhì)剛度、應(yīng)力/應(yīng)變)是調(diào)控在體多種細(xì)胞(如肌肉細(xì)胞、神經(jīng)細(xì)胞等)生物學(xué)行為的關(guān)鍵物理因素。為了進一步構(gòu)建細(xì)胞力學(xué)微環(huán)境,西安交通大學(xué)仿生工程與生物力學(xué)研究所(BEBC)和孫曉龍教授課題組合作采用“點擊(click)化學(xué)”和 “去點擊(declick)化學(xué)”等反應(yīng)開發(fā)了一種新型力學(xué)性質(zhì)可調(diào)及化學(xué)結(jié)構(gòu)可控的水凝膠體系。
該水凝膠體系的反應(yīng)機理是通過小分子基團化學(xué)反應(yīng)實現(xiàn)的,通過“點擊反應(yīng)”在共軛分子受體上發(fā)生胺-硫醇以及硫醇-硫醇的取代反應(yīng),以及通過“去點擊反應(yīng)”添加DTT在中性反應(yīng)條件下形成新的共軛受體,通過不同的化學(xué)反應(yīng)分別調(diào)控水凝膠的形態(tài)和力學(xué)性質(zhì)。水凝膠1是整個反應(yīng)凝膠體系的基礎(chǔ),是通過銅催化的炔基-疊氮點擊化學(xué)反應(yīng)形成的聚乙二醇(PEG)水凝膠(圖1)。

圖1. 水凝膠反應(yīng)機理圖
通過氨基-巰基置換,巰基-巰基置換的化學(xué)反應(yīng),在室溫以及中性緩沖液條件下,分別向水凝膠1種加入線性PEG,最終形成水凝膠2和水凝膠3;通過添加DTT和H2O2最終形成含有二硫鍵的水凝膠4(圖2)。作者分別利用流變儀,紫外-可見分光光度計,核磁共振儀等儀器測試和追蹤了化學(xué)反應(yīng)和結(jié)構(gòu)轉(zhuǎn)化的過程。
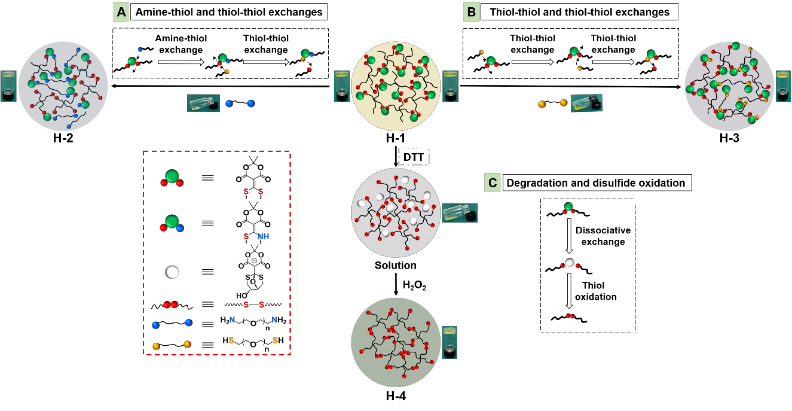
圖2. 水凝膠體系反應(yīng)示意圖
基于干細(xì)胞治療在治療各種疾病方面顯示出巨大的潛力,而有效的細(xì)胞傳遞是其中的關(guān)鍵挑戰(zhàn)之一。為了實現(xiàn)細(xì)胞傳遞,水凝膠可以提供細(xì)胞保護和一個穩(wěn)定的三維生理環(huán)境。在水凝膠體系中,由于正交反應(yīng),水凝膠1和水凝膠2的轉(zhuǎn)換可以在原位發(fā)生,對干細(xì)胞的包封具有細(xì)胞友好性,因此,在水凝膠2的形成過程中加入干細(xì)胞(hMSCs)。最終形成的水凝膠2為3D細(xì)胞培養(yǎng)提供了良好的支架。當(dāng)干細(xì)胞治療結(jié)束,凝膠需要快速降解時,通過加入DTT將水凝膠2快速降解,離心后釋放細(xì)胞。這些結(jié)果表明,水凝膠2作為細(xì)胞載體用于細(xì)胞治療的巨大潛力(圖3)。

圖3. 水凝膠在3維細(xì)胞培養(yǎng)中的應(yīng)用
以上相關(guān)成果發(fā)表在ACS Macro Letter(DOI: 10.1021/acsmacrolett.1c00276)上。論文的第一作者為西安交通大學(xué)BEBC博士生常樂,共同作者分別為西安交通大學(xué)BEBC博士生王聰,西安紅會醫(yī)院消化內(nèi)科副主任醫(yī)師韓霜博士,通訊作者為BEBC徐峰教授,共同通訊作者為西安交通大學(xué)孫曉龍教授。
論文鏈接:https://pubs.acs.org/doi/abs/10.1021/acsmacrolett.1c00276
- 山大周傳健教授、濟大趙松方/關(guān)瑞芳教授 AFM: 聚合誘導(dǎo)微相分離和多尺度靜電相互作用協(xié)同構(gòu)建高強韌、高有機硅含量的有機硅水凝膠 2025-07-03
- 華南農(nóng)大胡傳雙教授、林秀儀副教授、徐江濤副教授 Adv. Sci.:雙網(wǎng)絡(luò)離子水凝膠實現(xiàn)可穿戴電子器件電磁屏蔽與自供電傳感一體化 2025-07-03
- 太原理工大學(xué)張虎林教授 Adv. Sci.: 熱電凝膠賦能仿生多模自監(jiān)督指尖受體 2025-07-02
- 西南交通大學(xué)周紹兵教授團隊在《Progress in Materials Science》發(fā)表亞細(xì)胞傳遞納米材料綜述論文 2019-11-01
- 華科大吉曉帆教授團隊《Macromolecules》:利用羥基-炔點擊化學(xué)制備高分子量聚[2]索烴 2024-04-16
- 上海交大路慶華教授團隊 Adv. Sci.:一種基于點擊化學(xué)制備的纖連蛋白修飾型細(xì)胞層用于傷口修復(fù) 2024-01-10
- 蘇州大學(xué)陳紅教授/劉莊教授、上海大學(xué)孫樂樂副教授 Angew:點擊化學(xué)介導(dǎo)的細(xì)胞膜糖聚物工程以增強樹突狀細(xì)胞疫苗 2023-12-01
