實體腫瘤內因有限的血管分布、致密的細胞外基質以及弱酸性環境等不利因素,導致抗腫瘤藥物在瘤內的富集和滯留效率低下。納米載體能顯著增強抗腫瘤藥物的溶解性和血液循環時間,以及具有改善藥物體內分布等優勢。然而,據統計僅有0.7%左右的納米藥物能被有效遞送至腫瘤部位,雖然在降低藥物毒副作用等方面得到了改良,但如何大幅度提高納米藥物在腫瘤病灶的富集和滯留仍然面臨挑戰。
與藥物分子和納米顆粒不同,細菌可以活躍地游離血管系統并深入腫瘤組織深處,并且能借助腫瘤組織的乏氧區域以及免疫抑制環境長期定植于腫瘤內部。因此,細菌為瘤內藥物遞送及滯留提供了機遇。基于此,上海交通大學劉盡堯團隊報道了基于工程菌的實體瘤內聯合藥物的時空可控分布,可重編程免疫抑制微環境以優化抗腫瘤功效。
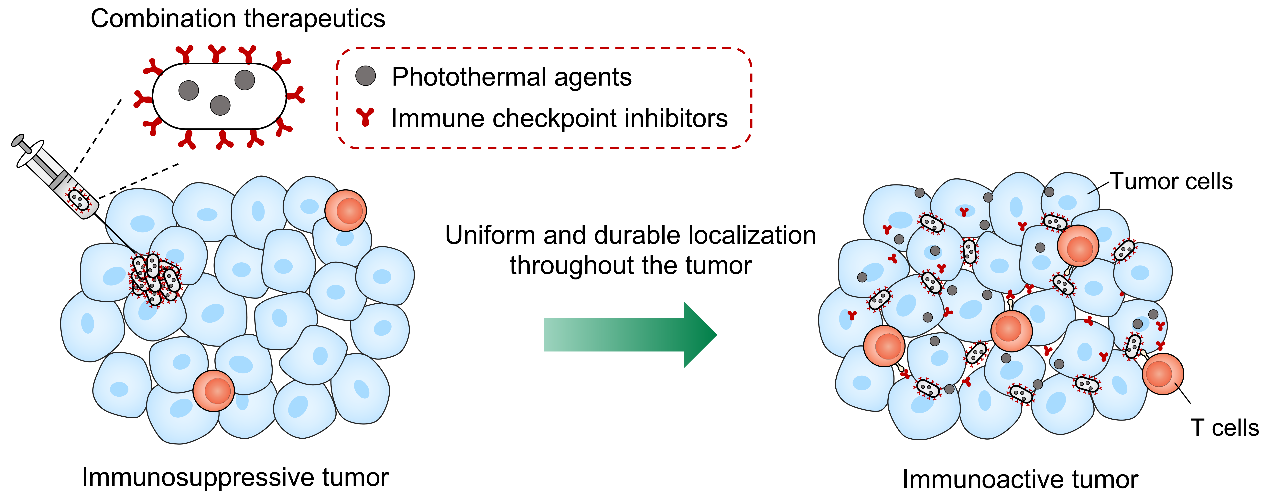
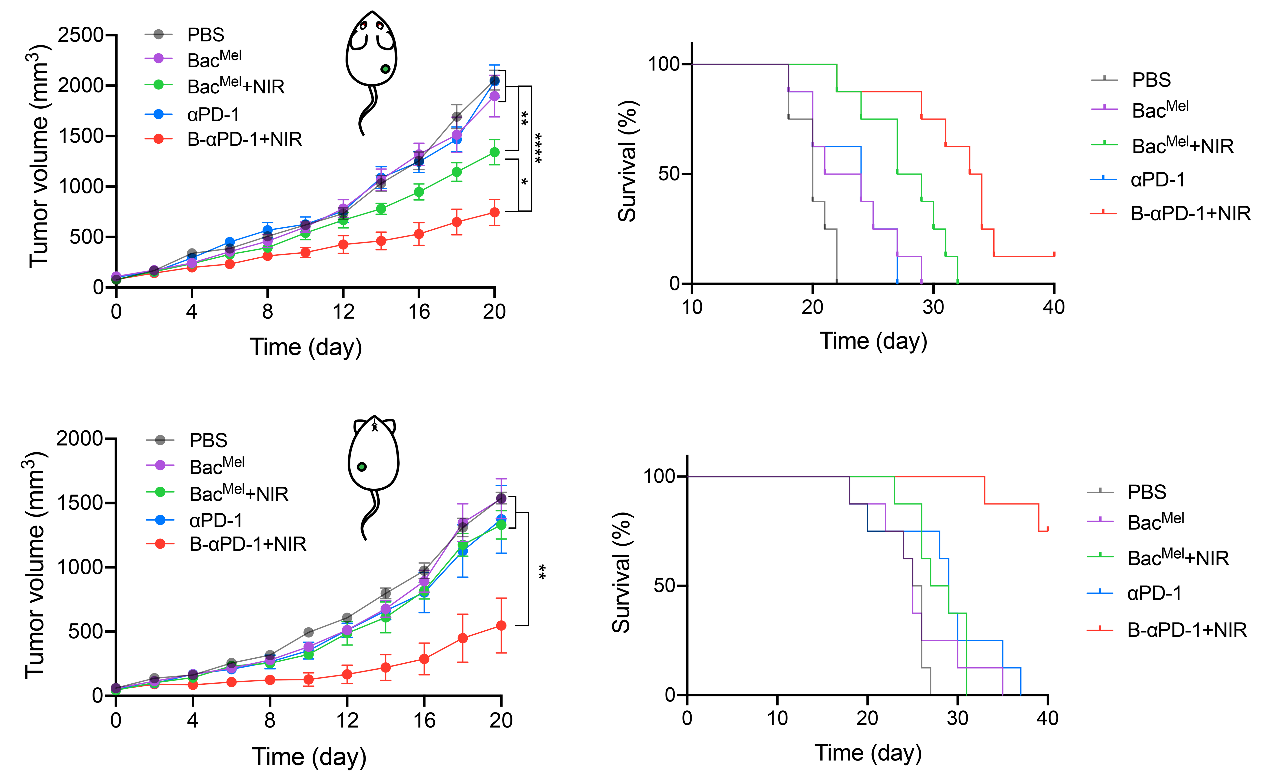
研究人員通過聯合基因工程和高分子化學手段,同時對細菌內外進行修飾,使細菌胞內負載光熱黑色素分子的同時表面通過多巴胺原位聚合錨定免疫檢查點抑制劑PD-1抗體。由于能夠充分定植于缺氧的瘤內環境中,細菌在離體腫瘤組織和小鼠在體腫瘤內均實現了光熱試劑和 PD-1 抗體均勻且持久的分布。值得一提的是,黑色素的時空可控分布提供了較長的治療窗口期,可通過激光輻照重復產生適度且均勻的熱量,以誘導強有力的熱觸發抗腫瘤免疫。與瘤內分布均勻且滯留持久的PD-1抗體相結合,雙重修飾的細菌可實現雙重免疫激活效應,協同重編程腫瘤免疫微環境。研究人員在小鼠皮下和原位乳腺癌模型中證明了這種方法的治療潛力,在抑制腫瘤生長和延長存活期方面均具有顯著優勢。該工作揭示了治療藥物如何以時空可控的方式分布于腫瘤中,并提出了雙重修飾細菌在腫瘤聯合治療中的應用策略。
上海交通大學醫學院分子醫學研究院博士后王露,助理研究員曹湞萍為該論文共同第一作者,劉盡堯研究員為通訊作者。該工作得到第十四批國家海外高層次人才引進青年項目、科技部重點研發計劃課題、國家自然科學基金委面上項目等支持。

論文鏈接:https://doi.org/10.1002/adma.202106669
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
- 蘇大附一院朱雪松/張一健/蔣定華、華東理工袁媛 BAM:“內外兼修”的基因工程水凝膠加速衰老骨修復 2025-05-26
- 紐約州立大學賓漢姆頓分校饒思圓課題組誠招博士、碩士研究生 - 化學、材料學、生物工程、電子工程、神經科學、基因工程 2025-04-11
- 上海交大劉盡堯團隊 Sci. Adv.:表面修飾賦能光活性基因工程菌 2024-03-10
- 華南理工大學分子聚集發光研究團隊誠聘師資博士后 - 合作導師:秦安軍、趙祖金、胡蓉蓉、王志明、馮光雪、宋波 2025-05-21
