針對(duì)這一挑戰(zhàn),吉林大學(xué)陳學(xué)思院士和孫靜教授研究團(tuán)隊(duì)從分子伴侶蛋白的動(dòng)態(tài)調(diào)控機(jī)制中獲得啟示,創(chuàng)新性地設(shè)計(jì)了一種活性聚類肽高分子作為組裝輔助因子,聚類肽是一類結(jié)構(gòu)獨(dú)特的合成高分子,其主鏈結(jié)構(gòu)與聚肽高分子類似,但不含手性中心且缺乏強(qiáng)氫鍵作用,這種結(jié)構(gòu)賦予其優(yōu)異的分子柔韌性和可調(diào)控的分子間相互作用,在功能性納米材料構(gòu)建中展現(xiàn)出巨大潛力。
研究團(tuán)隊(duì)通過(guò)模擬生物大分子的精準(zhǔn)組裝過(guò)程,采用生物活性聚類肽電解質(zhì)調(diào)控UA的原位動(dòng)態(tài)自組裝,成功構(gòu)建了具有pH響應(yīng)特性的螺旋納米纖維結(jié)構(gòu)(圖1)。該自組裝過(guò)程呈現(xiàn)明顯的三階段演化特征:首先形成納米級(jí)亞結(jié)構(gòu)單元,隨后組裝為病毒樣納米顆粒,最終自發(fā)組織成穩(wěn)定的螺旋納米纖維結(jié)構(gòu)(圖2)。研究證實(shí),該組裝體系的穩(wěn)定性受到多重因素的協(xié)同調(diào)控,特別是電荷比、鹽濃度、聚合度及溶液pH值等關(guān)鍵參數(shù)。值得注意的是,該體系展現(xiàn)出優(yōu)異的可逆pH響應(yīng)行為:在中性pH條件下維持穩(wěn)定的纖維形態(tài),而在酸性環(huán)境中則自發(fā)轉(zhuǎn)變?yōu)椴《緲蛹{米顆粒。這種智能化的形貌轉(zhuǎn)換特性顯著提升了納米載體在腫瘤組織中的滲透效率(圖3)。

圖1. 酸響應(yīng)性螺旋納米纖維的制備及抗腫瘤機(jī)理。
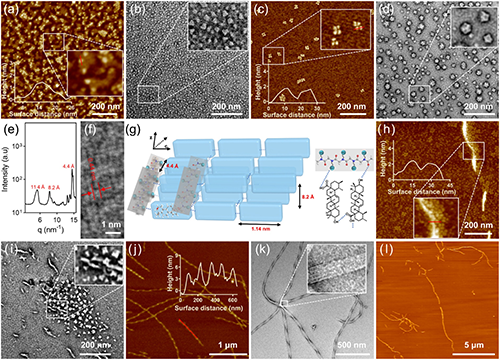
圖2. 螺旋納米纖維的形成過(guò)程。
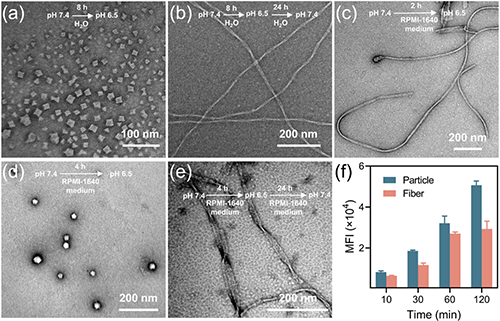
圖3. 螺旋納米纖維的pH響應(yīng)性。
通過(guò)引入酸響應(yīng)基團(tuán)和靶向分子乳糖酸(LA),該遞送系統(tǒng)實(shí)現(xiàn)了多重功能優(yōu)化:在酸性腫瘤微環(huán)境(TME)中高效轉(zhuǎn)變?yōu)閹д姾傻牟《緲蛹{米顆粒,顯著提升腫瘤細(xì)胞的特異性攝取(圖4);在細(xì)胞內(nèi)實(shí)現(xiàn)溶酶體逃逸并靶向線粒體;在高過(guò)氧化氫環(huán)境下觸發(fā)藥物可控釋放,通過(guò)誘導(dǎo)線粒體損傷途徑誘導(dǎo)細(xì)胞凋亡。同時(shí),部分釋放組分可在細(xì)胞質(zhì)中重新自組裝為纖維狀結(jié)構(gòu),顯著延長(zhǎng)藥物滯留時(shí)間(圖5)。實(shí)驗(yàn)證實(shí),該遞送體系展現(xiàn)出優(yōu)異的協(xié)同治療效果,其抗腫瘤效率顯著優(yōu)于單一療法,能夠有效抑制小鼠腫瘤生長(zhǎng)和轉(zhuǎn)移(圖6)。
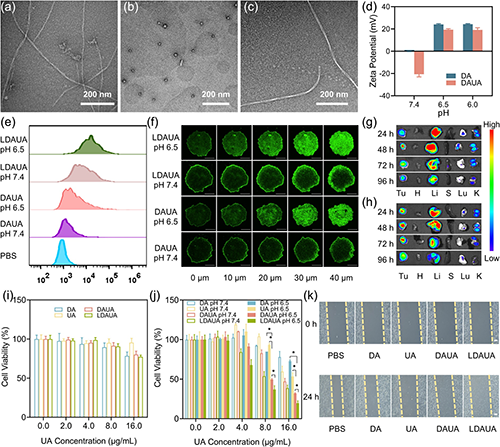
圖4. TME響應(yīng)性納米藥物的性能。
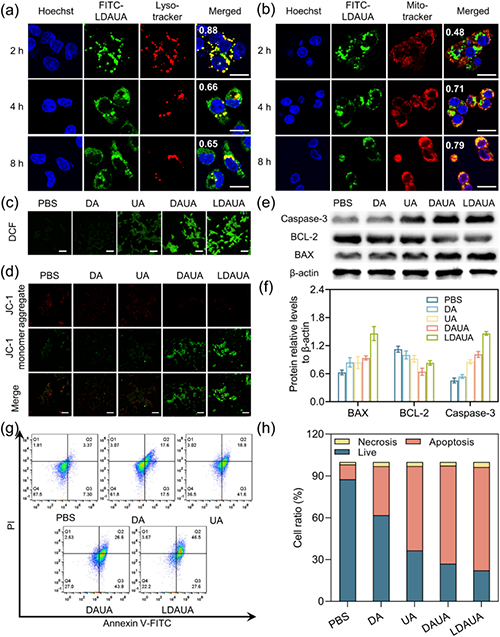
圖5. TME響應(yīng)性納米藥物的抗腫瘤機(jī)理。

圖6. TME響應(yīng)性納米藥物的體內(nèi)抗腫瘤和抑制轉(zhuǎn)移能力。
本研究提出的“天然藥物-活性聚類肽”仿生組裝策略,成功構(gòu)建了具有pH響應(yīng)性形貌轉(zhuǎn)換功能的智能納米纖維載藥系統(tǒng),有效解決了UA臨床應(yīng)用的關(guān)鍵瓶頸。該平臺(tái)不僅實(shí)現(xiàn)了UA的腫瘤靶向遞送和可控釋放,還通過(guò)線粒體損傷機(jī)制發(fā)揮協(xié)同抗腫瘤效應(yīng)。這一研究為天然產(chǎn)物的納米醫(yī)學(xué)應(yīng)用提供了新思路,并有望拓展至其他疏水性抗腫瘤藥物的遞送系統(tǒng)開發(fā),具有重要的臨床轉(zhuǎn)化價(jià)值。未來(lái)研究可進(jìn)一步優(yōu)化聚類肽的分子設(shè)計(jì),探索其在聯(lián)合免疫治療或靶向-化療協(xié)同中的應(yīng)用潛力。該工作以“Bioactive Assembly Cofactor-Assisted Ursolic Acid Helix for Enhanced Anticancer Efficacy via In Situ Virus-like Transition”為題發(fā)表在《Journal of the American Chemical Society》上,DOI: 10.1021/jacs.5c01214。文章第一作者是吉林大學(xué)博士后林敏博士,該研究得到國(guó)家自然科學(xué)基金委的支持。
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.5c01214
- 青科大李志波教授、孫靜教授團(tuán)隊(duì)系統(tǒng)評(píng)述:聚類肽高分子材料及其結(jié)構(gòu)與性能的研究 2018-01-09
- 中山大學(xué)吳鈞教授課題組《Adv. Funct. Mater.》:在治療型生物可降解高分子研究中取得新進(jìn)展 2019-12-28
- 福州大學(xué)生命科學(xué)與工程學(xué)院高純熊果酸提取技術(shù)獲成功 2008-12-08
- 港中大(深圳)趙征 / 唐本忠團(tuán)隊(duì) ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實(shí)現(xiàn)精準(zhǔn)光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團(tuán)隊(duì) Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細(xì)胞療法實(shí)體瘤療效受限的有效方法 2025-05-20
- 中科院納米能源所李琳琳?qǐng)F(tuán)隊(duì) JACS:具有動(dòng)態(tài)活性位點(diǎn)的Ga/Zn雙單原子納米酶提高癌癥治療 2025-05-10
