致密及堅硬的細胞外基質促進腫瘤細胞的生長、轉移以及對藥物的耐受。腫瘤組織升高的間質液壓和固體壓力阻礙藥物及治療性細胞在腫瘤部位的滲透和分布。因此,調控腫瘤細胞外基質及腫瘤微環境是改善腫瘤治療響應的一個重要策略。然而,如何調控腫瘤細胞外基質并增強腫瘤對藥物的治療響應是一個重大的挑戰。
傳統的腫瘤微環境調控集中于細胞外基質的降解和血管的調控,包括使用透明質酸酶、膠原酶等直接降解腫瘤細胞外基質;通過小劑量血管靶向抗體調控腫瘤血管,舒張血管壓力,裁剪枝化血管等。在前期的研究中,作者團隊發現某些蛋白和藥物可以同時實現腫瘤間質液壓和固體壓力降低、腫瘤血管舒張和腫瘤血管密度增加(Nano Lett. 2020, 20, 6526-6534; Theranostics 2019, 9, 24; Biomater. Sci. 2020, 8, 3907)。盡管這些手段都可以改善腫瘤的微環境,進而提高藥物在腫瘤內的富集和滲透,但其特異性仍然有待加強。
近日,蔣錫群教授團隊提出了一種多受體介導的腫瘤細胞外基質主動調控(mRMM-ECM)策略,用于阻斷腫瘤細胞的信號進而軟化腫瘤細胞外基質、顛覆腫瘤微環境。他們利用基因工程的方法,將表皮生長因子受體(EGFR)的納米抗體和整合素的配體RGD與類彈性蛋白進行融合,構建了一種可以同時靶向EGFR 和整合素αvβ3兩種受體的重組蛋白(RP-ER)和重組蛋白藥物偶聯體(RPDC-ER)。通過同時阻斷腫瘤細胞表面過表達的EGFR 和整合素受體,實現了對腫瘤細胞和腫瘤細胞外基質的調控,降低了腫瘤細胞中的F-actin,削減了腫瘤細胞外基質中膠原的含量,提高了藥物在細胞間的傳輸和在3D大細胞球(> 500微米)中的滲透。EGFR 和整合素αvβ3的同時靶向還逆轉了腫瘤的物理微環境,在5種腫瘤模型中降低了腫瘤的間質液壓、固體壓力和楊氏模量,促進了大分子藥物在腫瘤組織中的滲透和分布,提高了RPDC的腫瘤治療效果。該研究提出的多受體介導的腫瘤細胞外基質主動調控策略和RPDC藥物平臺將有助于克服傳統抗體和ADC藥物面臨的“結合位點障礙”(binding-site barrier)和瘤內滲透性差的缺點,為設計新型抗體及抗體藥物偶聯體,增強其藥物的瘤內遞送和分布提供了新思路。

圖1. (A) RP-ER 和RPDC-ER的結構示意圖,(B) WB分析不同RP處理對HeLa細胞的受體和信號分子的影響,(C) 不同RP處理后的HeLa細胞中的F-actin染色。
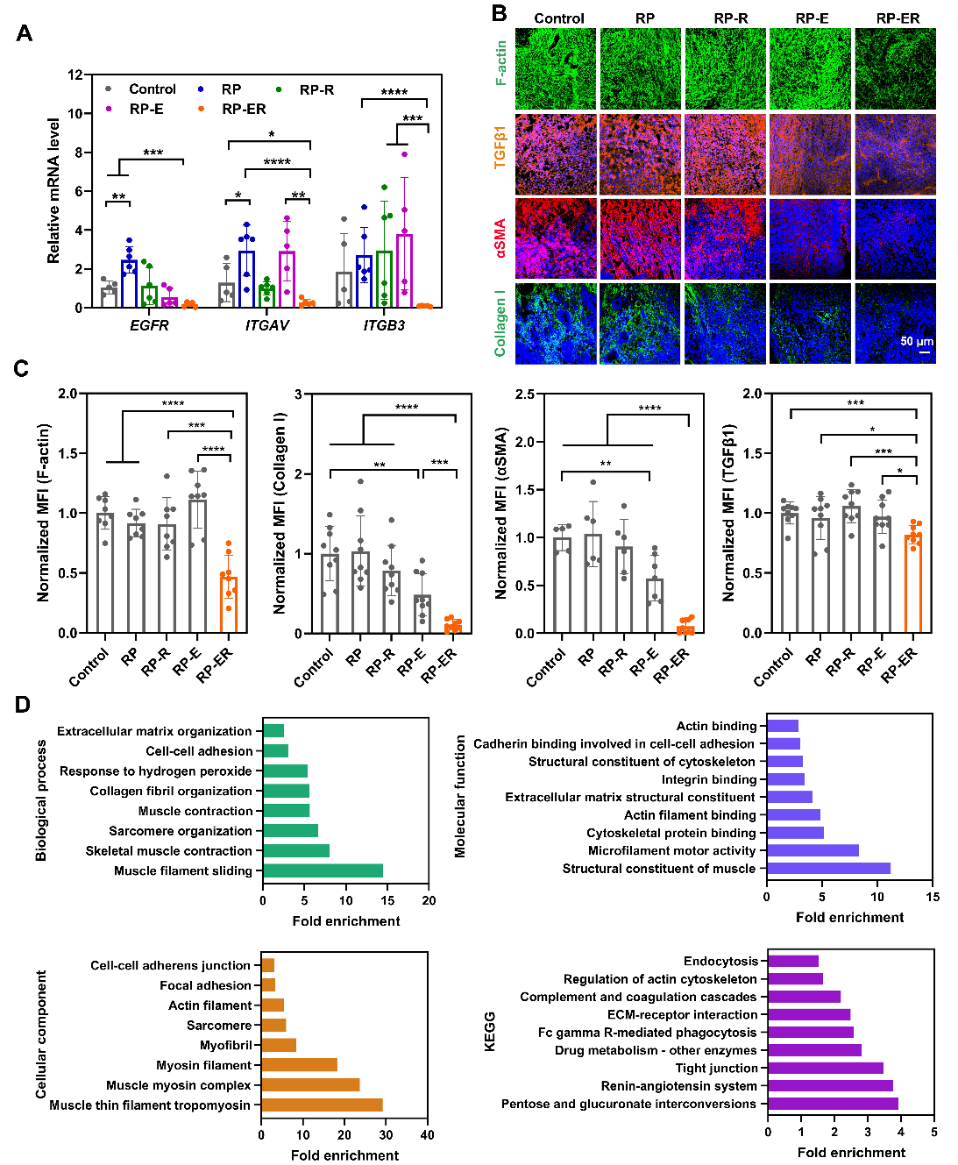
圖2. (A) 不同RP處理后HeLa腫瘤組織中細胞受體的mRNA表達情況,(B,C) 不同RP處理后HeLa腫瘤組織中的F-actin、TGFβ1、αSMA、Collagen I的表達情況。(D) RP-ER 處理后的HeLa腫瘤組織對未處理組相比的蛋白質組學分析。
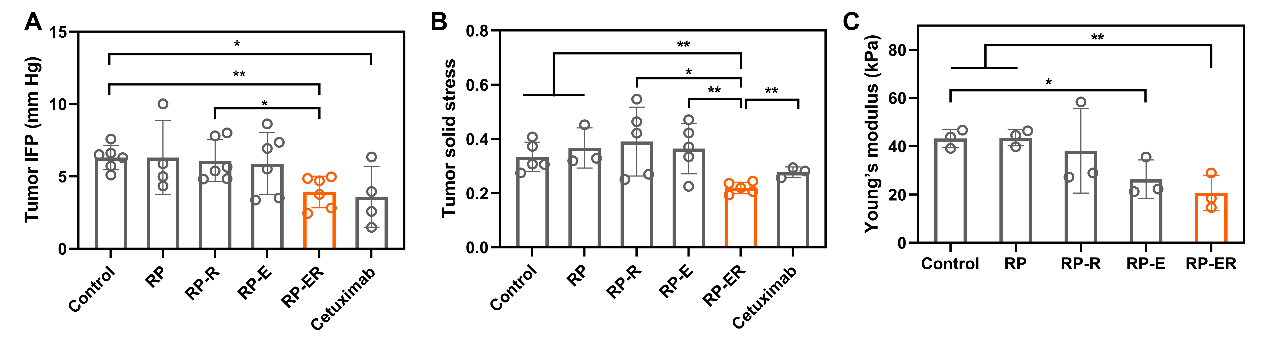
圖3. 不同RP處理后HeLa腫瘤的IFP (A)、固體壓力 (B)和楊氏模型 (C)。

圖4. (A)跨細胞轉運實驗示意圖,(B,C)不同RPDC與HeLa細胞孵育后跨細胞轉運的CLSM圖和熒光定量分析,(D) RPDC-ER在HeLa細胞中的跨細胞轉運效率,(E-N) 不同RPDC在HeLa細胞球中的滲透情況。

圖5. (A) 不同RPDC注射進小鼠體內后腫瘤血管處的藥物滲透情況,(B) A圖中血管外矩形區域的熒光強度隨時間的變化,(C) 血管中和(D)血管外100 μm處的熒光強度的變化。
上述相關成果已以“Modulating Tumor Extracellular Matrix by Simultaneous Inhibition of Two Cancer Cell Receptors”為題在Advanced Materials (DOI: 10.1002/adma.202109376 )在線發表,南京大學陳偉芝副研究員為第一作者,蔣錫群教授為通訊作者,埃默里大學的毛輝教授和南京鼓樓醫院的劉寶瑞教授對該項工作給與了幫助。該工作獲得了國家重點研發計劃、國家自然科學基金以及江蘇省前沿引領項目的支持。
原文鏈接:https://doi.org/10.1002/adma.202109376
- 華南理工大學趙鵬超、邊黎明《Mater. Today》: 液泡化凝聚層調節大分子藥物釋放動力學 2023-04-30
- 南京大學鼓樓醫院趙遠錦團隊《Adv. Mater.》:發明微針機器人-攻克口服胰島素難題 2021-09-18
- 浙江大學王本/唐睿康Angew:可誘導癌細胞鈣化的大分子抗腫瘤藥物 2021-01-19
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
