腫瘤細(xì)胞即使在氧氣充足的情況下也會通過糖酵解方式來進(jìn)行代謝,消耗大量葡萄糖并最終生成乳酸,這種現(xiàn)象被稱為腫瘤的有氧糖酵解,也叫做Warburg效應(yīng)。在這一過程中存在一個重要的限速酶,即M2型丙酮酸激酶(PKM2)。它在多種腫瘤細(xì)胞中高表達(dá)具有低活性的PKM2(二聚體),當(dāng)通過激動劑將低活性的PKM2二聚體轉(zhuǎn)變?yōu)楦呋钚缘乃木垠w后,有利于抑制糖酵解過程,阻斷腫瘤細(xì)胞的增殖作用,被視為有效的腫瘤藥物研發(fā)的新關(guān)注點(diǎn)。
國家納米科學(xué)中心李莉莉研究員,與哈爾濱醫(yī)科大學(xué)第四附屬醫(yī)院徐萬海教授和寶雞文理學(xué)院AIE研究中心馮海濤教授合作,共同開發(fā)了一種基于“可生物激活體內(nèi)組裝”納米技術(shù)的糖肽自組裝PKM2納米激動劑(GPNA1)。通過PKM2上游的葡萄糖水解酶(OGA)的水解作用,促使GPNA1從納米顆粒原位轉(zhuǎn)變?yōu)榧{米纖維結(jié)構(gòu),激活并有效提升PKM2活性。從高效促進(jìn)PKM2四聚化和捕獲PKM2減少核易位兩方面同時作用,有效抑制腫瘤增殖,最終協(xié)同增敏化療治療。對于高轉(zhuǎn)移的前列腺癌和三陰性乳腺癌,實(shí)現(xiàn)治療增效和轉(zhuǎn)移抑制。
本文要點(diǎn):
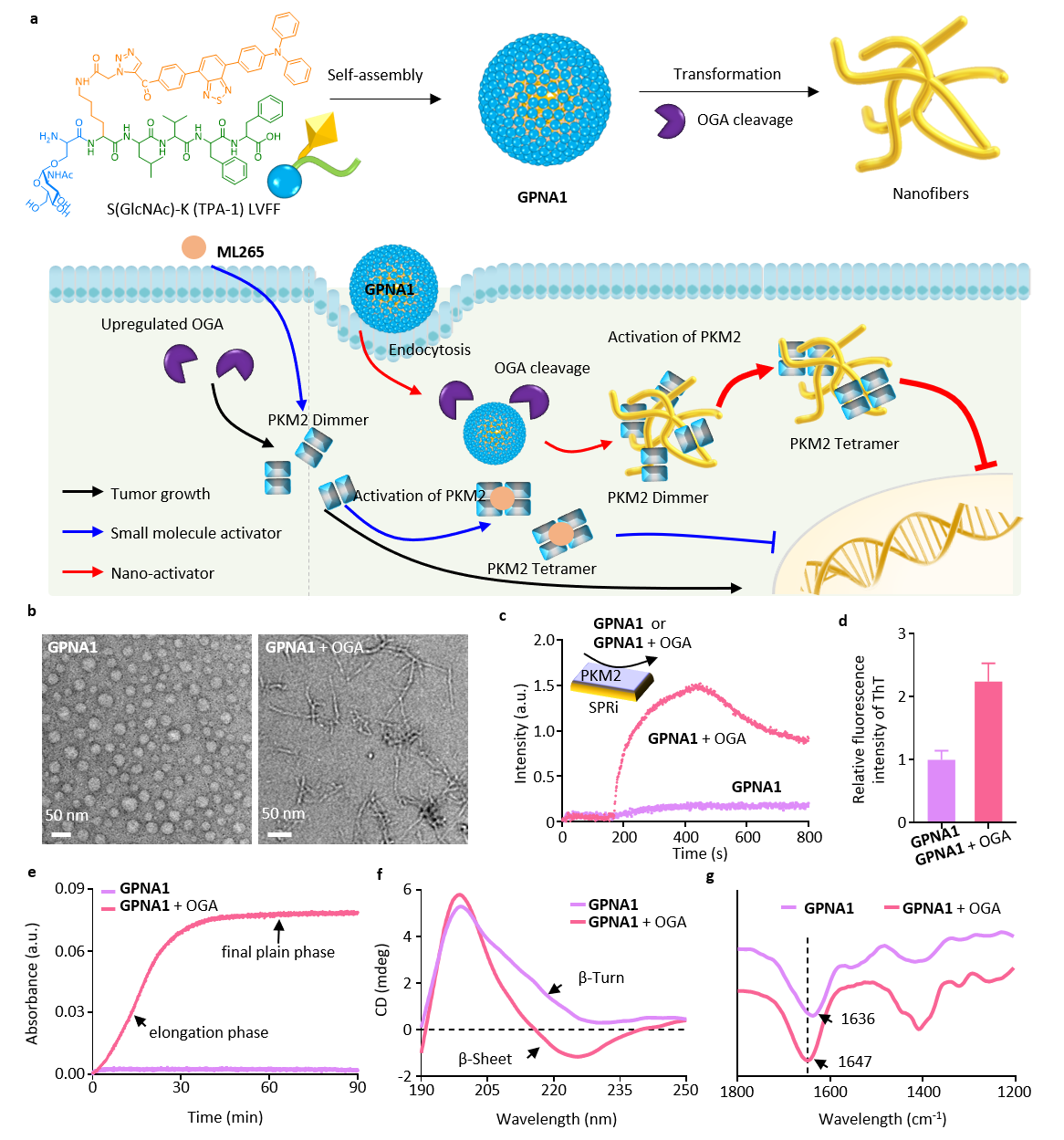
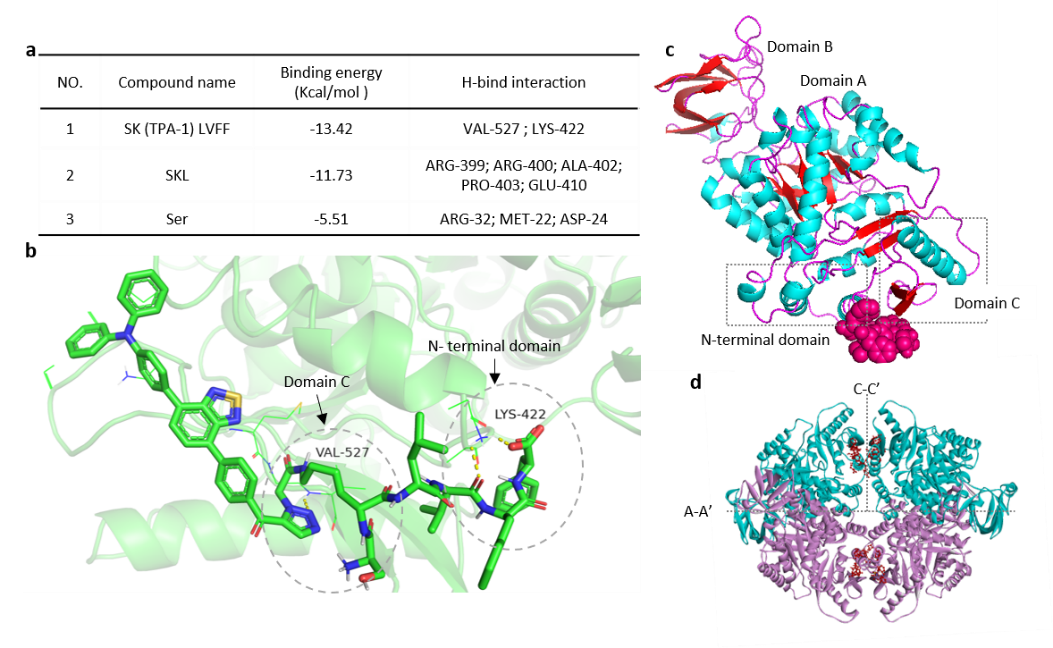
(1)實(shí)驗(yàn)設(shè)計的GPNA1能夠在OGA酶水解剪切下激活與PKM2的結(jié)合,結(jié)合位點(diǎn)在PKM2的N端區(qū)和C區(qū);同時,納米顆粒到納米纖維的變形,提升了與PKM2的結(jié)合穩(wěn)定性,從而有效促進(jìn)PKM2的四聚化。
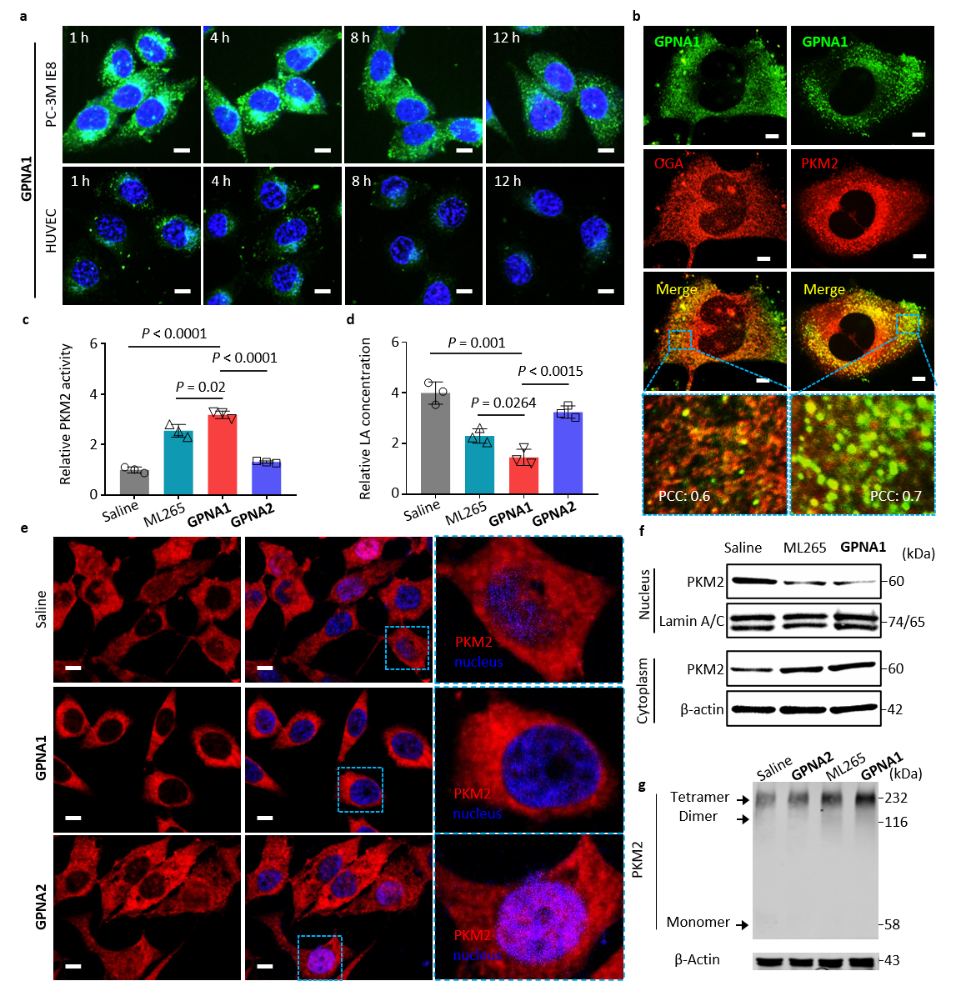
(2)實(shí)驗(yàn)結(jié)果表明,GPNA1可以高量長效滯留在腫瘤細(xì)胞內(nèi),與腫瘤細(xì)胞內(nèi)的OGA及PKM2良好的共定位,有效促進(jìn)PKM2的四聚化,抑制PKM2轉(zhuǎn)運(yùn)至細(xì)胞核。
(3)GPNA1的活性表明:其PKM2激活的AC50為9.9 μM,腫瘤細(xì)胞的IC50為40.8 μM,與化療藥物多西他賽聯(lián)合使用時,可將化療藥物的IC50降低4.3倍。通過納米激動劑的被動靶向機(jī)制,有效富集到腫瘤區(qū)域,利用納米纖維結(jié)構(gòu)實(shí)現(xiàn)腫瘤區(qū)域內(nèi)的長效富集和滯留,最終抑制腫瘤細(xì)胞有氧糖酵解,減少腫瘤細(xì)胞轉(zhuǎn)移。
(4)在荷瘤小鼠腫瘤模型中的結(jié)果表明,與單一化療(多西他賽或者阿霉素)治療相比,通過GPNA1的有氧糖酵解抑制,有效協(xié)同增敏了化療。對于高轉(zhuǎn)移的前列腺癌和三陰性乳腺癌,均體現(xiàn)出高效腫瘤生長抑制、腫瘤肺轉(zhuǎn)移抑制等活性,有效延長小鼠的生存期。

綜上所述,這種新開發(fā)的基于“可生物激活體內(nèi)組裝”納米技術(shù)的PKM2糖肽納米激動劑,提出了高效阻斷糖酵解的新策略,為高侵襲、高轉(zhuǎn)移腫瘤的治療以及化療增敏提供解決方案。本工作由哈爾濱醫(yī)科大學(xué)附屬第四醫(yī)院博士研究生侯大勇和王佳起,以及中國科學(xué)院理化研究所博士研究生肖五一為共同第一作者,國家納米科學(xué)中心李莉莉研究員、哈爾濱醫(yī)科大學(xué)第四附屬醫(yī)院徐萬海教授和寶雞文理學(xué)院AIE研究中心馮海濤教授為共同通訊作者,上述研究工作得到了國家自然科學(xué)基金、中科院前沿科學(xué)重點(diǎn)研究項(xiàng)目和國家自然科學(xué)基金區(qū)域重點(diǎn)項(xiàng)目的支持。
https://www.sciencedirect.com/science/article/abs/pii/S0142961222001624?via%3Dihub
- 港中大(深圳)趙征 / 唐本忠團(tuán)隊(duì) ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實(shí)現(xiàn)精準(zhǔn)光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團(tuán)隊(duì) Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細(xì)胞療法實(shí)體瘤療效受限的有效方法 2025-05-20
- 吉大陳學(xué)思院士、孫靜教授團(tuán)隊(duì) JACS:聚類肽輔助因子精準(zhǔn)調(diào)控熊果酸螺旋納米纖維原位動態(tài)組裝實(shí)現(xiàn)協(xié)同腫瘤增效治療 2025-05-13
