納米醫學是生物醫學的一個相對較新的領域,開發可降解的高效藥物傳遞系統(DDS)成為一個熱門的研究課題。光刺激的DDS可遠程激活、時間和空間高度精確。鄰硝基芐酯(ONB)給予一定光照后,可以發生不可逆光化學反應;在紫外光下,PONB的DDS系統可發生降解,釋放藥物的同時,裂解產物被排出體外,既滿足了高效的控制釋放需求,同時具有較低的生物毒性。然而,ONB基團只對紫外光敏感,且空間位阻較大。目前,主要通過膠束的方法構建紫外光響應的鄰硝基芐基DDS。而膠束結構不牢固,且紫外光組織穿透性差,生物毒性大,限制了其在生物體的應用。近紅外光對組織損傷小,穿透性強。稀土上轉換納米粒子可利用近紅外光激發將能量上轉換而發出紫外光的特性可激發鄰硝基芐裂解實現控制釋放,有望解決光響應DDS迫在眉睫的問題。
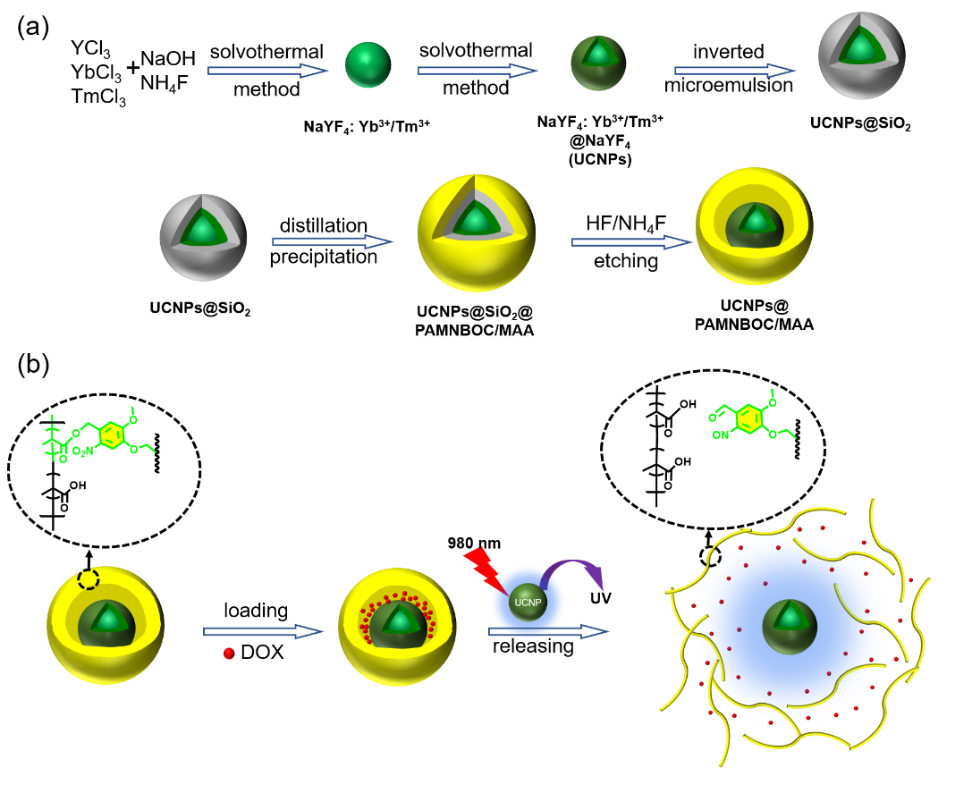
圖1(a)納米膠囊的合成路線和(b)藥物在納米膠囊上的負載和釋放紫外光譜。
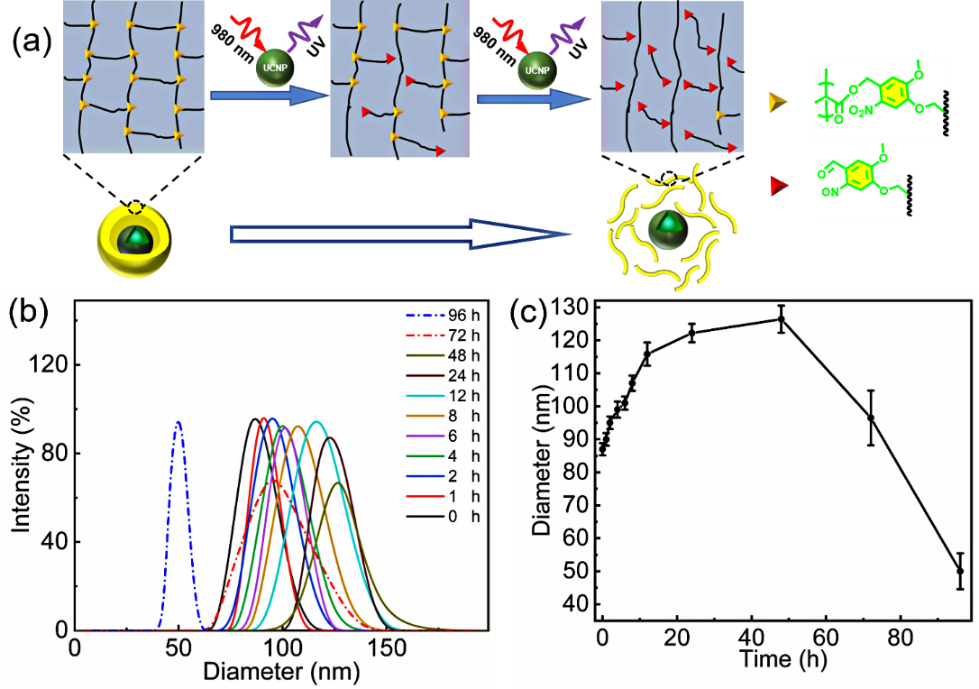
圖2(a)UCNPs@PAMNBOC/MAA 納米膠囊的聚合物殼隨著光照時間的增加而發生的降解過程;(b)不同NIR照射時間后的DLS曲線;(c)UCNPs@PAMNBOC/MAA納米膠囊粒徑隨光照時間的變化曲線。

通過細胞攝取實驗證明納米膠囊能夠被MCF-7細胞有效內化,并通過添加不同的內吞抑制劑研究其內化機理,結果表明納米膠囊是通過小窩蛋白介導的內吞途徑進入細胞中。進一步,對納米膠囊處理MCF-7進行了不同條件下的實驗。沒有納米膠囊的對照組和NIR組呈現較高的細胞存活率,證明NIR照射對細胞是生物友好的。游離的DOX組呈現較少的細胞存活率,表明化療藥物產生了更大的細胞毒性。而空白納米膠囊及其光解副產物對MCF-7細胞具有低毒性。載藥后納米膠囊在近紅外光作用下呈現較低的細胞存活率,證明近紅外輻射刺激是控制DOX-UCNPs@PAMNBOC/MAA納米膠囊釋放DOX并誘導細胞凋亡的有效方法。
論文鏈接:https://doi.org/10.1021/acs.biomac.2c01404
- 東華大學史向陽教授團隊 AFM:微流控合成無載體全活性的金屬酚納米膠囊用于腫瘤的化療-化學動力學治療-免疫治療 2024-12-02
- 青島大學于濤和亓洪昭團隊《ACS AMI》:多階段響應型納米復合物通過改善口服核酸藥物在結腸內的蓄積和分布來減輕潰瘍性結腸炎 2022-04-08
- 澳門大學王瑞兵教授團隊:簡易方法制備基于瓜環的納米囊以及用于靶向光敏治療 2019-06-21
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
