中科大王育才/蔣為團隊《Nat. Nanotechnol.》:寫進教科書級的發現,提出納米藥物腫瘤遞送新理論
2023-09-15 來源:高分子科技
腫瘤血管是納米藥物進入腫瘤組織的主要途徑,因此納米藥物的高效遞送在很大程度上依賴于腫瘤血管系統。目前的研究范式主要基于1986年首次提出的“增強滲透和滯留效應”(EPR, Enhanced Permeability and Retention effect)。該理論認為,腫瘤血管內皮細胞屏障是納米藥物滲透到腫瘤組織的最后一道防線,納米藥物可以利用腫瘤血管的高滲透性來跨越這一屏障,從而直接進入腫瘤基質。然而,臨床前和臨床研究的結果均顯示,納米藥物對腫瘤的遞送效率仍然不盡如人意。某些研究數據甚至表明,納米載體僅能將大約0.7%的藥物有效遞送至腫瘤組織。這一發現不禁引發了疑問:是否存在其他尚未被充分認識的機制,這些機制可能在非內皮細胞屏障層面阻礙了納米藥物的血管外滲透?


圖1. 納米顆粒在腫瘤血管外形成血池。

圖2. 急性炎癥誘導的血池噴發將“困住”的納米顆粒釋放到腫瘤間質中。
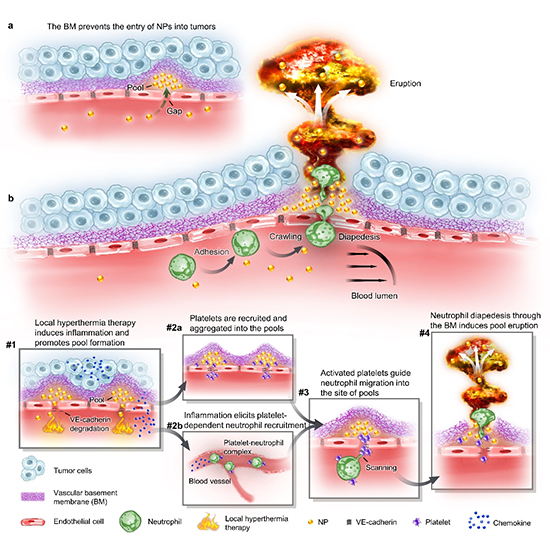
圖3. 基底膜是阻止納米顆粒進入腫瘤的屏障,通過急性炎癥突破基底膜屏障,誘導火山式噴發。
原文鏈接:https://www.nature.com/articles/s41565-023-01498-W
版權與免責聲明:中國聚合物網原創文章。刊物或媒體如需轉載,請聯系郵箱:info@polymer.cn,并請注明出處。
(責任編輯:xu)
相關新聞
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內遞送 2025-05-03
- 浙江大學姚克、韓海杰團隊 Sci. Adv.:基底膜仿生水凝膠促進角膜損傷少瘢痕化愈合 2024-12-23
- 川大李旭東/陳君澤、港城大譚超良團隊 Adv. Mater.: 多酚-氨基酸縮合物庫用于超高載藥量納米藥物的高通量連續流生產 2025-02-12
- 天工大高輝/李曉暉團隊 Acta Biomater.:二甲雙胍多功能納米藥物克服具核梭桿菌介導的結直腸癌化療耐藥與免疫抑制 2025-02-11
- 南方醫大沈折玉教授 Biomaterials: 中空介孔三氧化二鐵納米藥物介導的瘤內Fe3+/2+循環催化用于大腫瘤鐵死亡治療 2024-11-01
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 上科大葉春洪課題組 Nat. Commun.:超高等離子體手性光學信號的構筑及動態調控 2025-06-08
