自COVID-19出現以來,基因治療和mRNA疫苗取得了快速進展,使得核酸藥物在醫學領域的地位日益突出。然而,相對較大且帶負電荷的核酸分子容易受到細胞膜陰離子脂質層的靜電排斥,導致跨膜運輸困難。進入體內的核酸分子將面臨免疫系統的清除、血液中核酸酶的降解以及細胞內溶酶體核酸酶的降解。在缺乏合適的載體的情況下,核酸藥物的體內效率仍然很低。目前由脂質體、陽離子聚合物、和無機納米粒子組成的核酸納米遞送載體尚不完善,包括細胞轉染效率低、對細胞的細胞毒性以及在生理條件下不穩定等。因此,載體如何實現將核酸藥物選擇性的遞送至靶細胞的細胞質中發揮作用是目前亟需解決的問題。
近期,暨南大學戴箭課題組設計構建了一種可以響應腫瘤的微酸性環境通過膜融合的方式將核酸直接遞送至腫瘤細胞質的溶瘤病毒樣納米顆粒OV@FN。OV@FN由負載核酸的納米核心NA-Zn@G和表達溶瘤病毒融合膜糖蛋白(mVSV-G)的雜合膜囊泡FN構成,其中FN可響應腫瘤微酸性環境通過膜融合的方式將負載核酸的納米內核遞送至腫瘤細胞胞質中,隨后NA-Zn@G響應腫瘤細胞細胞質中高濃度的谷光甘肽以在腫瘤細胞質中精準釋放核酸。研究結果表明:與正常細胞相比,OV@FN可以有效且精準地將核酸藥物遞送至腫瘤細胞的細胞質中。更重要的是,FN可有效誘導腫瘤細胞之間相互融合形成合胞體以促進細胞內核酸藥物的擴散,大大增加了基因治療的效果。因此,OV@FN為基因遞送載體和腫瘤免疫治療平臺提供了一種新的策略。相關的工作以“Oncolytic Virus-Like Nanoparticles for Tumor-Specific Gene Delivery”為題發表在Advanced Functional Materials。
【文章要點】
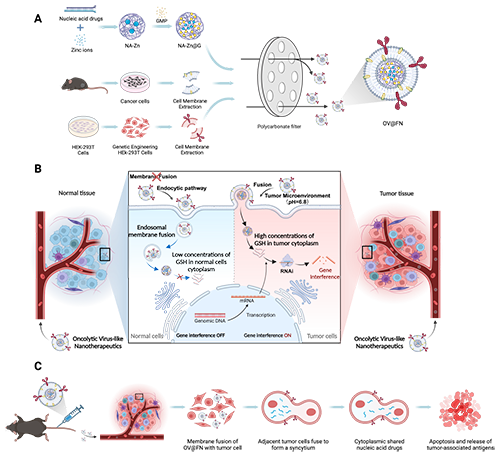
圖1 溶瘤病毒樣納米顆粒OV@FN的制備和性能示意圖。
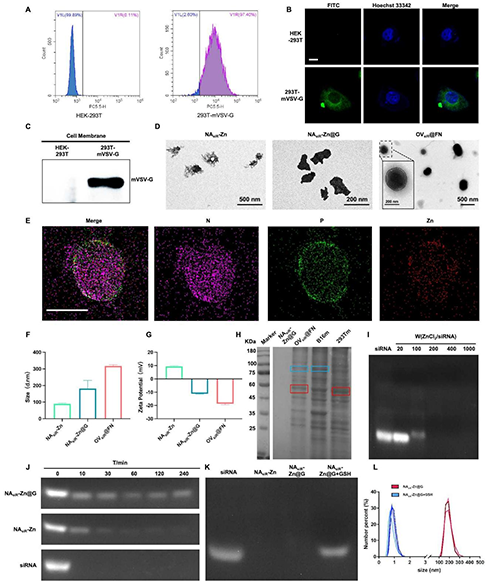
圖2 OV@FN的材料表征
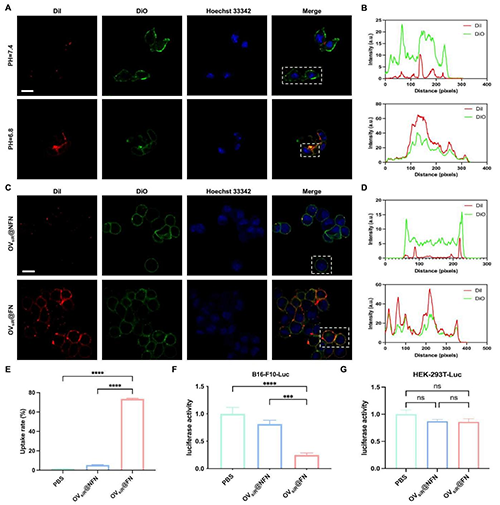
圖3 OV@FN的體外性能表征。

圖4 雜合膜FN上mVSV-G促進腫瘤細胞之間的融合。

圖5 雜合膜FN對荷瘤小鼠的治療效果。
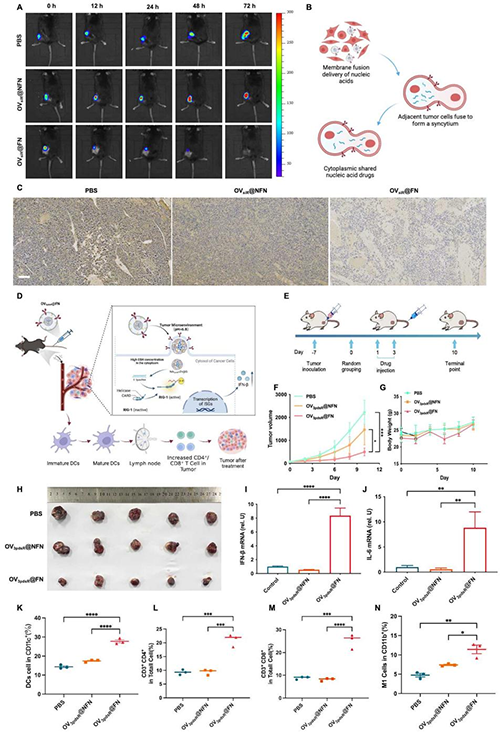
圖6 OV@FN的體內基因遞送效率。
綜上所述,本研究提出了用于核酸遞送的溶瘤病毒樣納米顆粒OV@FN。OV@FN將腫瘤特異性抗原與病毒融合蛋白相結合,顯示出增強的腫瘤靶向性和激活強腫瘤特異性免疫反應的能力。OV@FN在腫瘤弱酸環境中表現出高效的核酸遞送能力,為RNAi治療提供了安全有效的納米顆粒。此外,OV@FN可以誘導腫瘤細胞相互融合并在腫瘤部位形成合胞體。合胞體表面的mVSV-G和合胞體裂解后釋放的腫瘤相關抗原可以與核酸藥物配合,誘導強烈的腫瘤特異性免疫反應。OV@FN通過模仿病毒結構揭示了可擴展的核酸藥物遞送平臺,也為擴展基于病毒的腫瘤免疫治療提供了新的仿生策略和理念。
論文信息:
Oncolytic Virus-Like Nanoparticles for Tumor-Specific Gene Delivery
Yuchao Li#, Haiyuan Yang#, Xiaoqing Zong, Xiaodi Li, Pengfei Yuan, Caiqi Yang, Xinjie Chen, Xiaodie Yan, Yaoqi Wen, Tianci Zhu, Wei Xue, Jian Dai*.
Advanced Functional Materials
DOI: 10.1002/adfm.202314898
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202314898
- 上海市第一人民醫院馬小軍/東華大學何創龍 Bioact. Mater.:TME響應復合水凝膠靶向抑制MYC驅動型骨肉瘤生長與轉移 2025-01-17
- 南方醫科大學沈折玉教授、新加坡國立大學陳小元教授《Adv. Mater.》:一種用于MRI引導腫瘤鐵死亡治療的與邏輯門 2023-09-28
- 北化徐福建團隊/青大胡浩團隊《J. Control. Release》綜述:基于多糖的腫瘤微環境響應藥物遞送系統用于腫瘤治療 2023-08-25
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 上科大葉春洪課題組 Nat. Commun.:超高等離子體手性光學信號的構筑及動態調控 2025-06-08
- 四川大學李建樹教授/謝婧副研究員、大連理工孫文研究員 AFM:一種具有pH響應性和軟骨滲透能力的超分子納米顆粒治療骨關節炎 2025-04-30
- 天工大高輝教授團隊 AHM:提升結直腸癌的抗血管生成基因療法重塑炎癥和免疫抑制性腫瘤微環境 2024-12-26
