結直腸癌(CRC)部位存在高豐度的具核梭桿菌(Fn),促使腫瘤部位炎性因子升高,促進腫瘤新血管生成;同時,巨噬細胞向M2型極化,下調體內的CD4+ T細胞和CD8+ T細胞,形成免疫抑制微環境。
基因治療是將正常或治療性基因遞送到靶細胞中,復制表達,達到治療疾病的目的,在疾病治療領域已展現出巨大的應用前景。鑒于Fn感染對CRC治療效果的不利影響,迫切需要開發具有高抗菌活性和安全性的多功能基因遞送體系來消除Fn的不良影響,提高對Fn感染的CRC的治療效果。
針對上述挑戰,天津工業大學高輝教授課題組研發了一種治療Fn感染CRC的新策略,制備了一種具有腫瘤細胞主動靶向性的基因遞送體系(AFGTs-PEG),遞送抗菌劑月桂酸(LA)和抗血管生成基因(sFlt-1),通過抗Fn實現了對Fn感染CRC的增強基因治療。這為高效安全的抗腫瘤基因遞送載體的構建及致病菌相關腫瘤的治療問題提供了具有臨床應用前景的研究思路。
2024年12月20日,該研究成果以“Remodeling the Inflammatory and Immunosuppressive Tumor Microenvironment for Enhancing Antiangiogenic Gene Therapy of Colorectal Cancer”為題發表在Advanced Healthcare Materials上(DOI: 10.1002/adhm.202402887)。
高輝教授課題組前期研究發現月桂酸(LA)具有優異的抗Fn活性。作者將LA和靶向分子4-羧基苯硼酸(PBA)修飾到低分子量的聚乙烯亞胺(OEI)中并與LA自組裝得到LA@OLP(AFs)。AFs復合sFlt-1并與DSPE-mPEG共組裝得到LA@OLP/sFlt-1/DSPE-mPEG(AFGTs-PEG)。體內實驗表明AFGTs-PEG可以有效清除Fn,降低體內炎性因子,抑制M1巨噬細胞向M2巨噬細胞的極化,上調CRC部位CD4+ T細胞和CD8+ T細胞,改善腫瘤炎癥和免疫抑制微環境,解除Fn對抗血管生成基因治療的不良影響,在活體水平協同發揮顯著的抗血管生成作用,實現對Fn感染CRC的增強的基因治療效果(圖1a和b)。細胞毒性、溶血和H&E染色實驗表明AFGTs-PEG具有良好的生物相容性和安全性。
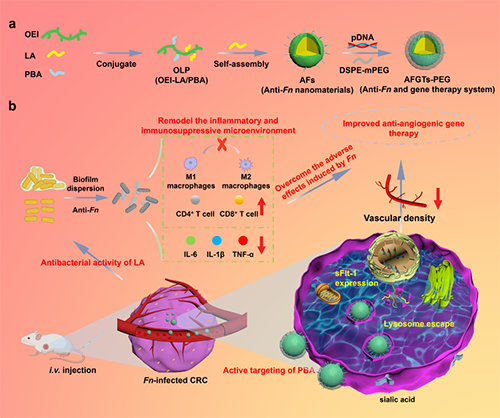
圖1. AFGTs-PEG的制備及治療Fn感染CRC示意圖。
通過平板涂布法和菌落計數(圖2a和b)表明AFGTs-PEG具有與LA相似的抗Fn性能。掃描電鏡(圖2c)表明AFGTs-PEG處理后,Fn的細胞膜被破壞,形態結構發生明顯變化。AO/EB染色(圖2d)再次表明AFGTs-PEG造成了Fn的大量死亡。結晶紫染色和3D成像(圖2e和f)顯示AFGTs-PEG對Fn形成的生物被膜具有高效的分散清除能力。

圖2. 體外抗菌和抗生物膜性能。
基于AFGTs-PEG優異的體外抗菌性能,作者進一步評價其體外抑制血管生成效果。凝膠電泳實驗(圖3a)表明AFGTs-PEG在氮磷比為10時可以有效復合sFlt-1,從而避免sFlt-1在運輸過程中的泄露和過早釋放問題。質子緩沖能力實驗(圖3b)表明AFs具有與基因遞送“黃金標準”PEI25K相似的內含體逃逸能力。細胞轉染實驗(圖3c-e)表明LA:OLP(質量比)為3:1時且氮磷比為10時,轉染效率最高,因此選用此比例進行后續實驗。體外抑制血管形成實驗(圖3f和g)表明即使在Fn感染條件下,AFGTs-PEG也能顯著地降低血管的形成。

圖3. 體外轉染性能。
藥物體內分布實驗(圖4a)表明,AFGTs-PEG可以顯著和長時間地富集在腫瘤部位。通過統計小鼠的體重和腫瘤體積(圖4c-e),表明AFGTs-PEG治療后,小鼠體重沒有發生明顯的降低,并且腫瘤的體積最小,表明其優異的抗腫瘤性能。通過腫瘤組織的H&E染色和小鼠生存周期(圖4f和g)表明AFGTs-PEG生物相容性和安全性高,并不會對身體造成明顯的損傷。

圖4. 體內生物分布和抗腫瘤性能。
基于AFGTs-PEG優異的抗腫瘤性能,作者進一步探究AFGTs-PEG的抗腫瘤機理。首先,通過原位熒光雜交技術標記腫瘤部位的Fn,結果顯示(圖5a和b)經AFGTs-PEG治療后,腫瘤部位的Fn豐度顯著降低。酶聯免疫吸附實驗(圖5c-e)也表明體內的細胞因子(IL-1β、TNF-α和IL-6)水平降低至正常水平。腫瘤部位的血管密度(圖5f和g)和sFlt-1表達(圖5h和i)表明,經AFGTs-PEG治療后,sFlt-1大量表達,腫瘤部位的血管密度顯著降低。
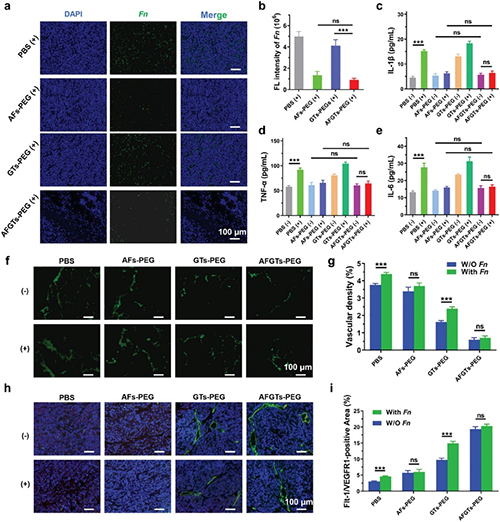
圖5. 重塑體內腫瘤炎癥微環境。
接下來,研究了AFGTs-PEG對免疫抑制微環境(圖6a-d)的改善。結果表明AFGTs-PEG治療后,M1巨噬細胞向M2巨噬細胞的極化被抑制。同時,CD4+ T細胞和CD8+ T細胞的水平顯著升高。

圖6. 重塑體內免疫抑制微環境。
總之,AFGTs-PEG通過遞送抗菌劑LA和抗血管生成基因sFlt-1,協同免疫相關細胞和基因治療實現了對Fn感染CRC的安全高效治療。值得注意的是,與常見的治療策略不同,抗血管生成基因治療是一種新穎的、安全高效的癌癥治療策略。與化療藥物不同,通過合理的遞送體系設計可以對不同腫瘤實現有效的抗血管生成基因治療,進一步體現了本研究成果在致病菌感染腫瘤治療中的巨大應用前景。
天津工業大學碩士畢業生牛家振和教師蘇美慧為該論文的第一作者,高輝教授為通訊作者。
論文鏈接:https://doi.org/10.1002/adhm.202402887






