基于多肽抗原的個性化腫瘤疫苗是一種極有前景的腫瘤免疫療法,然而現有多肽抗原的體內免疫效力仍然較弱,一方面是因為游離抗原肽在體內易酶解,無法有效回流至淋巴結被樹突狀細胞攝取和遞呈;另一方面由于鑒定得到的多肽抗原理化性質各異,難以用統一的載體材料來實施負載。因此,開發可負載多種特異性抗原肽的普適性載體材料仍然十分需要。
中國科學院長春應用化學研究所陳學思院士和宋萬通研究員團隊近年來致力于高分子腫瘤疫苗載體的研究,先后開發了以甘露聚糖為外殼、聚乳酸為內核的核殼結構仿病毒納米顆粒疫苗載體(Biomaterials, 2022, 284:121489; Nano Research, 2022, 15: 1183–1192; Fundamental Research, 2024, doi.org/10.1016/j.fmre.2023.03.018),以雜環分子修飾聚乙烯亞胺免疫刺激聚合物為基礎的“自佐劑”疫苗載體(Advanced Materials, 2022, 34(10): e2109254; CCS Chemistry, 2024, 6:1278–1288; Sci. Bull. 2024, 69(7), 922-932),以動態共價水凝膠為基礎的單劑緩釋疫苗載體(Advanced Materials, 2021, 33(3): 2004559; Journal of Controlled Release, 2023, 353, 289-302; Adv. Healthc. Mater., 2024, 34, 2400886)等,用于蛋白及多肽抗原的擔載與遞送。
近期,該團隊針對個性化多肽抗原理化性質各異的問題,利用聚噁唑啉方便功能化及良好生物相容性的特點,合成了一種基于聚噁唑啉的普適性多肽疫苗載體。該載體由多嵌段聚噁唑啉鍵合TLR7/8激動劑IMDQ構成(PMMEBOx-IMDQ),通過預留雙鍵與修飾有組織蛋白酶B敏感鏈段(CGFLG)的特異性抗原肽的點擊化學反應,可以普適性實現對多種抗原肽的鍵合擔載(圖1)。該載體的使用能夠顯著提升抗原肽向淋巴結的富集水平,大幅提高刺激產生的效應CD8+ T細胞水平,能夠讓多種“無效”的抗原肽變為“有效”的腫瘤抗原而得以應用。

圖1 PMMEBOx-IMDQ-peptide的制備流程及體內免疫機制示意圖
研究者首先改變羧基噁唑啉單體的投料順序,制備了兩種聚噁唑啉PMMEBOx-R/B-IMDQ疫苗載體,用于調控IMDQ佐劑位于聚合物中的位置。將OVA模型抗原肽(CGFLGSIINFEKL)鍵合于載體上獲得的疫苗納米顆粒直徑為25 nm左右,可顯著刺激DC活化(圖2)。

圖2 PMMEBOx-R/B-IMDQ-OVA兩種載體的制備流程示意圖及DC激活表征
PMMEBOx-R/B-IMDQ依靠其納米顆粒特性,可以顯著提升OVA肽的淋巴結富集水平,并使抗原肽駐留在淋巴結內長達6天。此外,其小納米尺寸還使得抗原肽有效滲透進淋巴結副皮質區,從而提升DC的激活及交叉遞呈(圖3)。

圖3 PMMEBOx-R/B-IMDQ-OVA兩種疫苗顯著提升了OVA肽的淋巴結駐留及滲透
將PMMEBOx-R/B-IMDQ-OVA納米疫苗用于B16-OVA腫瘤模型的治療,可有效抑制B16-OVA腫瘤的生長,并在脾臟中產生大量的OVA特異性殺傷T細胞。此外,PMMEBOx-R/B-IMDQ-OVA納米疫苗相較于游離OVA肽,使小鼠脾臟重量提升了約2.5倍、使小鼠腹股溝淋巴結重量提升了約5.0倍,證明提升了抗原肽系統性免疫響應水平(圖4)。

圖4 PMMEBOx-R/B-IMDQ-OVA疫苗在B16-OVA腫瘤模型上可有效抑制腫瘤生長并產生OVA特異性殺傷T細胞
隨后,該團隊從已報道的MC38細胞的突變新抗原中選擇了3種疏水抗原肽(Adpgk、Dgapt1、Resp1)進行擔載鍵合,制備了PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1三種納米顆粒疫苗。這些疏水抗原肽雖然是腫瘤特異性抗原,但由于其理化性質問題無法有效激活體內免疫反應,相反,PMMEBOx-B-IMDQ載體鍵合的抗原均能產生明顯的免疫響應,三種疫苗混合制備的cocktail疫苗取得了出色的腫瘤抑制效果(圖5)。

圖5 PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1可有效抑制MC38腫瘤生長并產生系統性免疫響應
由于這一鍵合疫苗形式非常穩定,研究者們最后還探究了靜脈注射方式使用該疫苗在體內產生的系統性免疫水平。研究結果證明該疫苗體系可以作為靜脈注射方式使用,產生強于皮下的細胞免疫水平(圖6)。
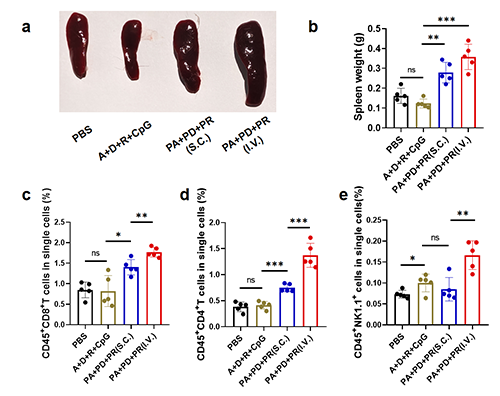
圖6 靜脈注射PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1可進一步提升體內系統性免疫響應
綜上,本研究開發了一種能夠普適性鍵合多種特異性抗原肽的疫苗載體PMMEBOx-B-IMDQ。該載體能夠顯著提升多肽的淋巴結駐留能力并大幅提升抗原肽的系統性免疫響應,極大的提升了特異性抗原的利用率,為特異性多肽疫苗研究提供了新思路。該工作近期以“Uniform polymeric nanovaccine platform for improving the availability and efficacy of neoantigen peptides”為題發表在《Nano Letters》上(Nano Lett., 2024, 24(33):10114-10123. doi: 10.1021/acs.nanolett.4c02196.).長春應化所陳宏宇博士研究生為該論文的第一作者,宋萬通研究員和陳學思院士為該論文的通訊作者。該研究得到國家自然科學基金,中國科學院國際合作基金,吉林省科技發展計劃等項目的支持。
原文鏈接:https://doi.org/10.1021/acs.nanolett.4c02196
下載:Uniform polymeric nanovaccine platform for improving the availability and efficacy of neoantigen peptides






