近年來,mRNA(信使核糖核酸)作為一種新型的治療劑,在預防和治療多種疾病方面展現出巨大的潛力。mRNA可以攜帶遺傳信息,指導細胞合成特定的蛋白質,從而實現治療目的。然而,如何將mRNA高效、特異性地遞送到目標器官和細胞,一直是該領域面臨的主要挑戰。脂質納米顆粒(LNP)作為一種高效的遞送載體,被廣泛用于mRNA的遞送,然而,如何優化LNP的性能,提高其遞送效率和靶向性,仍然是當前研究的熱點。
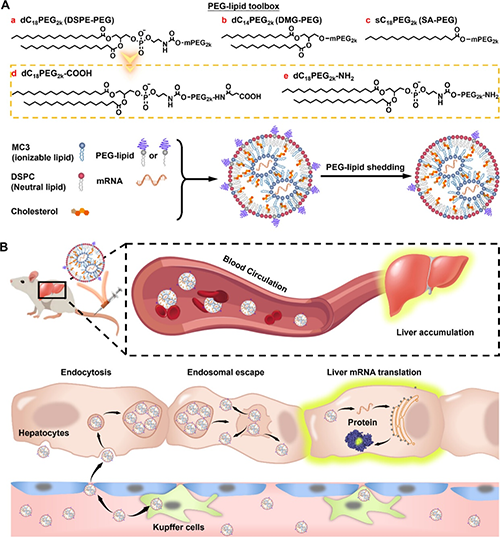
圖1. PEG化脂質的化學結構及其對LNPs性能的影響示意圖。

圖2. PEGylation化脂質的結構與De-PEGylation速率的關系。

圖3. De-PEGylation速率對LNP的藥代動力學和生物分布的影響。
主要發現包括:
1.PEG脫落速率決定靶向命運(圖3)
適度脫落(DMG-PEG):平衡循環時間與肝細胞靶向,提升mRNA在肝實質細胞中的表達。
穩定包覆(DSPE-PEG):延長血液循環,但肝臟沉積效率顯著降低。
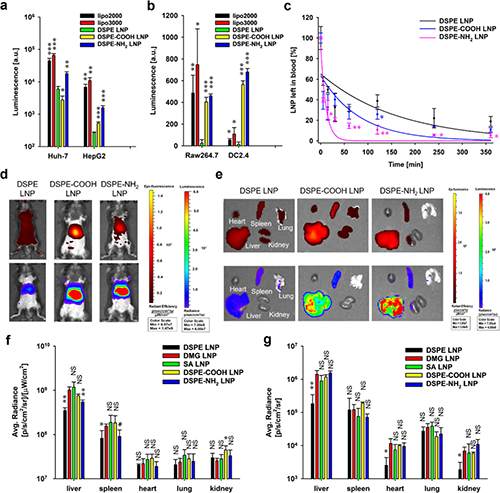
圖4. PEGylation化脂質末端基團修飾對LNP的體內遞送效果影響。
2.末端基團“微調”引發效率躍升(圖4)
將PEG末端基團從甲氧基替換為羧基(-COOH)或氨基(-NH?),可加速PEG脫落并增強LNPs與肝細胞相互作用,使肝臟mRNA遞送效率提升2-3倍。
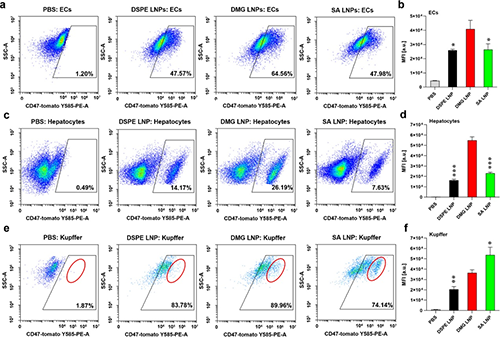
圖5. PEGylation化脂質對LNP肝臟亞細胞遞送的影響。
3.細胞類型特異性遞送(圖5)
通過調控PEG結構,成功實現LNP在肝實質細胞、Kupffer細胞和內皮細胞間的靶向差異:
SA-PEG LNP:偏好Kupffer細胞(占肝臟沉積量的68%);
DMG-PEG LNP:肝實質細胞遞送效率提升40%。
本研究全面揭示了PEGylation化脂質在LNP介導的mRNA肝臟遞送中的多面作用,為優化LNP的設計提供了新的思路。未來的研究將進一步探討PEG化脂質與離子化脂質之間的相互作用,以及如何通過調控PEG化脂質的結構來提高mRNA的遞送效率。希望這項工作能夠幫助大家更好地理解PEGylation化脂質在mRNA遞送中的重要作用,同時也為器官靶向遞送的LNP的設計提供參考。
原文鏈接:
Gao, M.; Zhong, J.; Liu, X.; Zhao, Y.; Zhu, D.; Shi, X.; Xu, X.; Zhou, Q.; Xuan, W.; Zhang, Y.; Zhou, Y.; Cheng, J.Deciphering the Role of PEGylation on the Lipid Nanoparticle-Mediated mRNA Delivery to the Liver. ACS Nano, 2024
https://doi.org/10.1021/acsnano.4c09399
