一.止血難題:傳統方法不夠用?
隨著止血技術的不斷突破,諸多宏觀止血劑能利用自身結構黏附或填充傷口從而實現超快止血,但是它們對易拆卸、抗傷口粘連等協同的術后護理需求仍束手無策。微納尺度的材料雖能通過構筑適配傷口微結構的血凝塊實現更加精準和動態的止血,但僅能“按程序”結合有限種類的細胞或蛋白,這讓凝血速度和血凝塊動態性大打折扣。如何讓材料像人體血小板一樣靈活并加速凝血,成為了亟待解決的難題。
二.血小板啟發的微納顆粒:“學會”并“超越”血小板的功能

這項替代血小板的顆粒材料有多強?
1. 像樂高一樣自由組裝:替代血小板的顆粒通過超分子力“拼裝”成貼片、涂層等形態,適配不同止血場景。
2. 遇水秒變“止血戰士”:接觸血液后,顆粒瞬間釋放,與血細胞、血漿蛋白動態結合,形成自愈合血凝塊。
3. 45秒超快止血:在抗凝豬實驗中,肝臟出血45秒止住,動脈出血60秒搞定,止血后輕松拆卸,無二次出血和術后粘連!對比傳統止血材料,止血時間和失血量分別縮短80%和85%。
為何能超越血小板?
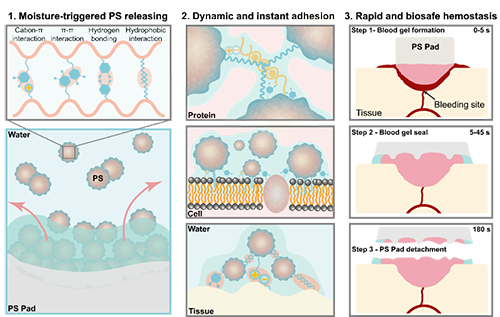
圖1. 血小板啟發的顆粒材料通過水觸發可快速釋放內部的替代血小板的顆粒并組裝蛋白、細胞和組織從而實現高效安全的止血。
三.替代血小板的顆粒的四大亮點:“超越”血小板的本領如何煉成?
1. 可調節的超分子修飾:像樂高一樣自由組裝和拆卸
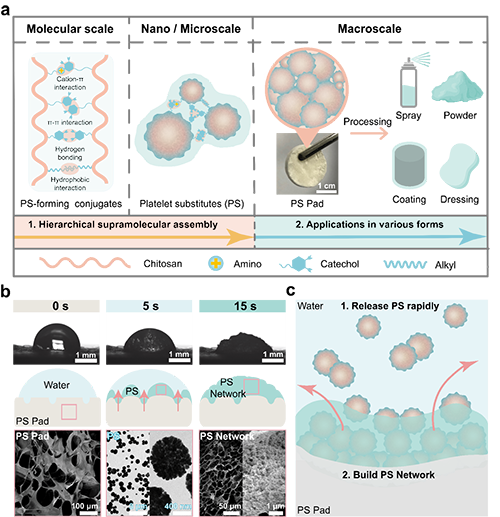
圖2. 血小板啟發的超分子顆粒的可加工和濕響應釋放特性。
2. 即時凝血和自愈能力:超越“血小板”的凝血速度和動態性

圖3. 血小板啟發的顆粒貼片的體外凝血性能
3.血凝塊的多尺度動態結構:紅細胞“砌墻”,白蛋白“搭橋”

圖4. 替代血小板的顆粒與細胞和蛋白組裝的多尺度動態結構
4.即時黏附濕組織微結構:如“天然血凝塊”那般無縫貼合
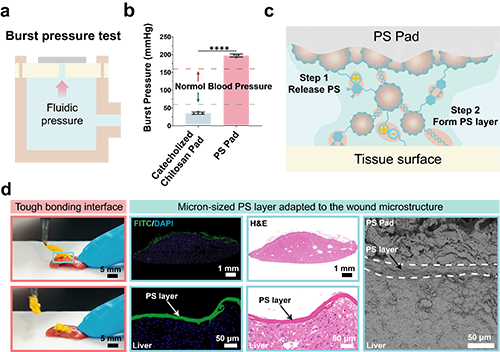
圖5. 血小板啟發的顆粒貼片的濕組織黏附性能
四.血小板啟發的顆粒貼片的應用示例
1.超快止血和按需拆卸
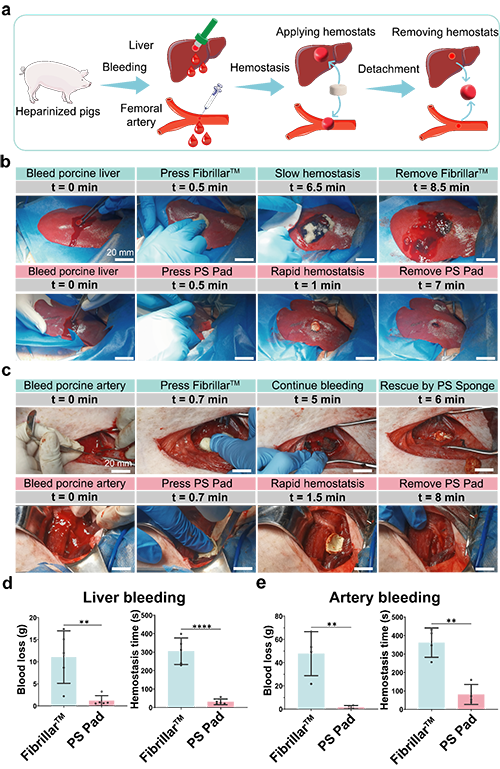
圖6. 血小板啟發的顆粒貼片在抗凝豬上的止血性能
2.術后抗粘連:傷口護理的額外優勢

圖7. 血小板啟發的顆粒貼片的抗術后粘連性能
五.機制揭秘:血小板啟發的顆粒貼片的止血、拆卸和抗粘連

圖8. 血小板啟發的顆粒貼片的止血和抗粘連機制
六.未來應用:創傷急救、手術臺的新希望
這項研究設計了一種釋放替代血小板的納米顆粒的多尺度超分子材料,其具有模擬血小板的微結構和超越血小板的非特異性結合細胞和蛋白的能力,從而即時地構筑具有多層級結構的自愈合血凝塊,這為滿足快速、動態等多元化止血需求提供了新的解決方案。
同時,團隊已授權兩項國家發明專利并正推進這種材料的臨床轉化,在未來其或將作為戰地急救包,對大動脈出血實現一貼即止;作為止血快、易拆卸的外科手術神器,從此告別術后粘連并發癥;或作為戶外運動、日常創傷的“救命貼”。
原文鏈接:https://doi.org/10.1002/adfm.202422686
- 南京大學李承輝/金鐘 Angew.:新型金屬超分子聚合物作為人工界面層助力液態鋰金屬電池性能新突破! 2025-06-29
- 吉林大學姜世梅教授團隊 JACS:基于超分子-共價協同策略構筑高性能單組分膠黏劑 2025-06-29
- 西北師大王榮民教授Macromolecules:“Graft from”RAFT和超分子主客體化學制備聚(香草醛)抗微生物納米環 2025-06-11
- 特定復合糖類可抑制癌細胞擴散 2009-07-08
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 上科大葉春洪課題組 Nat. Commun.:超高等離子體手性光學信號的構筑及動態調控 2025-06-08
- 四川大學李建樹教授/謝婧副研究員、大連理工孫文研究員 AFM:一種具有pH響應性和軟骨滲透能力的超分子納米顆粒治療骨關節炎 2025-04-30
