最近的研究中,可將外部能量或化學信號轉化為機械動能的自推進納米馬達因其在生物醫學應用中的巨大潛力而受到越來越多的關注。與傳統無運動特征的納米載體系統相比,納米馬達的運動能力使其可以主動穿透細胞膜進入細胞,并實現增強的腫瘤滲透。納米馬達可將激光的光能轉化為熱能,從而通過熱泳動驅動用于細胞內藥物遞送及組織穿透。考慮到金(Au)的光熱特性,不同形態的Au已通過共價結合或噴射涂層技術與納米載體結合以構建熱泳納米馬達。然而,在這些納米馬達中Au的尺寸大多數都大于10 nm,這不利于最大化Au的光熱轉化效率及納米醫學應用,并且尺寸較小的Au更易實現在納米馬達上的可控分布。最近,荷蘭埃因霍溫理工大學Jan van Hest教授課題組將聚乙二醇-b-聚(D,L-丙交酯)(PEG-PDLLA)共聚物自組裝,通過透析誘發形變制備了碗狀聚合物囊泡(bowl-shape Polymersomes),因其形貌類似口形紅細胞又可稱為Stomatocytes。各向異性的Stomatocytes自帶的不對稱流線型結構使其可在外部刺激的推動下進行定向運動,因而被作為納米馬達的基底平臺,進行了廣泛研究。其中,涂覆了Au的Stomatocytes(Au-Stomatocytes)可以利用Au的光熱特性,在激光照射下進行定向的熱泳動,并具有觸發光熱治療(photothermal therapy, PTT)的潛力。此外,Stomatocytes的內部空腔還可進一步用于負載藥物或功能化納米顆粒,從而擴展Stomatocytes的治療活性。
考慮到腫瘤的高效治療如化療、放療及PTT等總是伴隨著腫瘤細胞免疫原性死亡的發生,這將導致損傷相關分子模式(DAMPs)的釋放和抗腫瘤免疫的激活。然而,在PTT過程中對腫瘤部位進行局部激光照射引起的高溫會使大多數腫瘤細胞壞死,從而釋放過量的DAMPs、誘發炎癥反應、引發細胞因子風暴,使光照區域皮膚嚴重損傷并使腫瘤易復發轉移。因此,有必要設計一種智能納米藥物,可在PTT后緩解過度活化的免疫反應,從而在抗腫瘤免疫激活和炎癥反應可控性之間取得平衡。
為了最大限度地發揮Au-Stomatocytes在PTT中的優勢,東華大學史向陽教授/沈明武研究員團隊將具有多種類酶活性和抗炎能力的氧化鈰納米顆粒(CeO2-x NPs)整合進Stomatocyte體系中,通過簡單的方法制備了一種表面修飾金納米顆粒(Au NPs)、內部負載CeO2-x NPs、外圍進一步仿生偽裝癌細胞膜(cancer cell membranes,CM)的納米藥物,可作為雙驅動納米馬達用于運動增強的腫瘤PTT(圖1)。負載的CeO2-x NPs不僅可以作為炎癥清除劑調控PTT后的炎性腫瘤微環境(tumor microenvironment, TME),還可以利用類酶活性在缺氧的TME中產生O2,進一步增強PTT的效果。
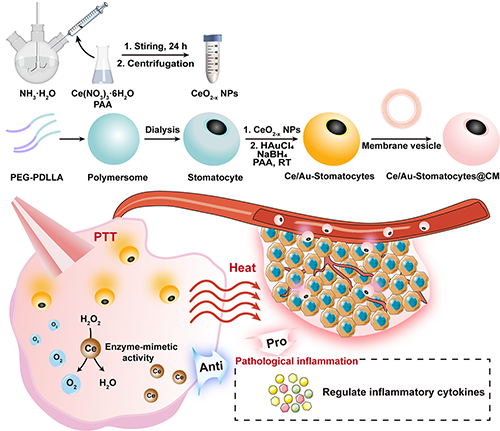
圖1. Ce/Au-Stomatocytes@CM的合成及其用于體內抗腫瘤光熱治療示意圖。
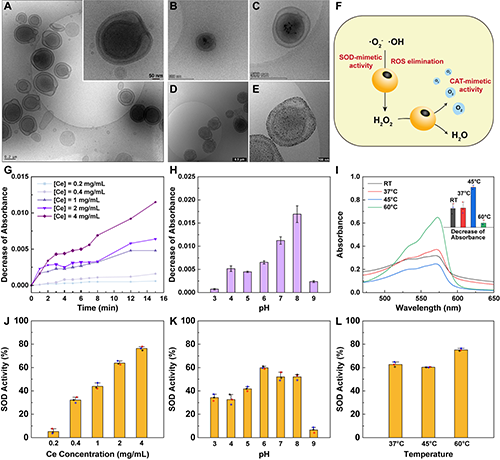
圖2.(A-E)不同階段Stomatocytes的cryo-TEM圖;(F)Ce/Au-Stomatocytes的類酶活性作用機制;(G-I)不同條件下Ce/Au-Stomatocytes的類CAT酶活性;(J-L)不同條件下Ce/Au-Stomatocytes的類SOD酶活性。

圖3.(A-C)Ce/Au-Stomatocytes的光熱性能;(D-I)Ce/Au-Stomatocytes在不同條件下的運動性能。
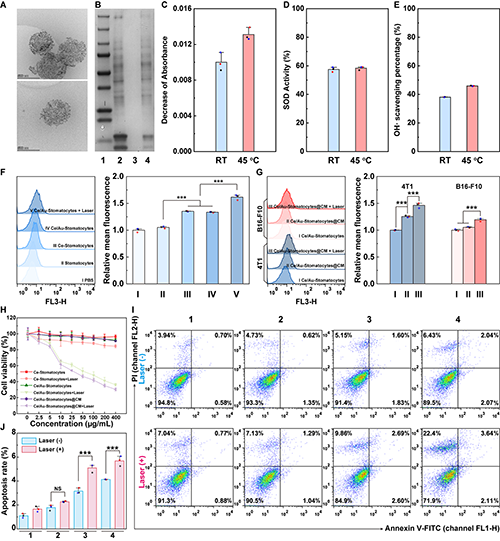
圖4.Ce/Au-Stomatocytes@CM的(A)cyro-TEM圖及(B)SDS-PAGE圖;(C-E)Ce/Au-Stomatocytes@CM在不同條件下的類酶活性;(F)不同Stomatocytes在4T1細胞中的吞噬情況;(G)Ce/Au-Stomatocytes@CM在不同細胞中的吞噬情況;經不同處理后4T1細胞的(H)細胞活力圖及(I-J)凋亡情況流式分析圖。
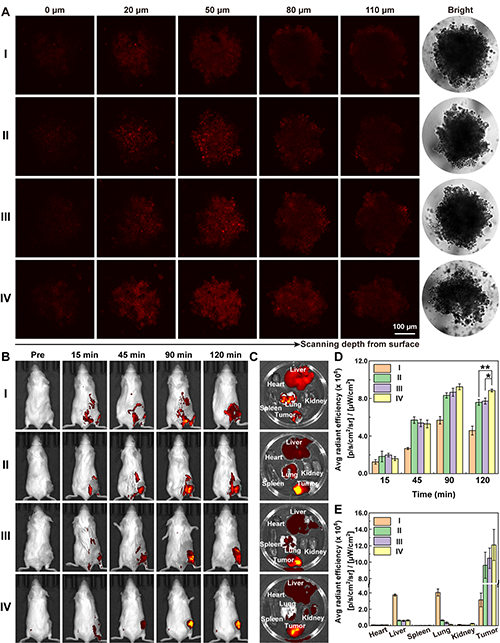
圖5.不同情況下Stomatocytes在(A)3D腫瘤細胞球中的滲透情況及(B-E)小鼠體內的生物分布(I: Au-Stomatocytes, II: Au-Stomatocytes@CM, III: Ce/Au-Stomatocytes@CM, and IV: Ce/Au-Stomatocytes@CM + Laser)。

圖6.(A)體內抗腫瘤治療時間線;(B)治療期間各組小鼠腫瘤體積變化;治療后各組小鼠(C)腫瘤細胞凋亡率及(D)HIF-1α表達水平;治療后各組(E)腫瘤外側皮膚的H&E 染色分析及(F)血清中細胞因子的表達情況。
總的來說,該研究設計的基于Stomatocytes的納米馬達具有多個優勢:1)表面沉積的Au NPs賦予了Stomatocytes光熱性能及運動特性,使其可以在激光照射下進行自主運動穿透腫瘤進行PTT;2)CeO2-x NPs的類酶活性使Stomatocytes不僅可以在TME中產生O2用于驅動運動、緩解腫瘤乏氧,還可以清除ROS以調控PTT后的炎癥水平;3)經CM仿生后的Ce/Au-Stomatocytes@CM可通過同源靶向聚集在腫瘤部位,在激光照射下穿透腫瘤進行PTT,同時調節炎癥反應緩解激光照射對表層皮膚的損傷。
文章鏈接:https://doi.org/10.1002/adfm.202500113
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
- 香港科大唐本忠院士團隊/武大王富安課題組 JACS:設計一種AIE螺環近紅外發射探針用于DNAzyme敏化增強的乳腺癌光熱治療 2024-12-14
- 北航潘曹峰教授/河南大學曹瑞瑞副教授團隊 AFM:用于運動能量收集和光熱治療的摩擦電功能紡織品 2024-12-07
- 武漢科技大學王曉強《Nano Lett.》:基于硼簇的“離液效應”構建細菌響應型水凝膠用于近紅外二區光熱治療 2024-04-09
