化療是目前癌癥最重要的治療手段之一,但化療藥物普遍存在半衰期短、副作用大和耐藥性差等缺點。高分子藥物載體具有對化療藥物進(jìn)行增溶、增加藥物在血液中的循環(huán)時間和能夠靶向投放藥物等優(yōu)勢。如何進(jìn)一步有效提高聚合物載體載藥量、實現(xiàn)抗腫瘤藥物在病灶處的更精準(zhǔn)釋放,是當(dāng)前高分子藥物載體材料研究急需解決的問題。
最近,大連理工大學(xué)王忠剛教授課題組設(shè)計合成了以剛性四苯基硅烷為核的星型四臂兩親性嵌段共聚物(BDSPFs)。該聚合物疏水段聚甲基丙烯酸二乙氨基乙酯和親水段聚乙二醇通過二硫鍵鏈接,兩嵌段的長度比系列可調(diào),且每個臂的端基被葉酸封端,由此得到的高分子藥物載體同時具有pH/還原雙響應(yīng)和葉酸主動靶向功能(圖1)。

圖1. 四苯基硅烷為核的星型四臂聚合物、自組裝及納米載體藥物輸送示意圖。
所制備聚合物的臨界膠束濃度低達(dá)1.03 mg/L,膠束的平均粒徑在103-143 nm,而且當(dāng)膠束濃度由1 mg/mL稀釋至 0.01 mg/mL以及時間延長至24小時后,其粒徑和分布變化不大,表現(xiàn)出優(yōu)異的膠束穩(wěn)定性(圖2)。

圖2.三種聚合物的臨界膠束濃度(a), BDSPF-1膠束在不同濃度下的粒徑變化(b), BPSPF-1膠束在不同時間的粒徑變化(c)。
實驗結(jié)果表明:該聚合物膠束的最大阿霉素載藥量可達(dá)32.3%。由于聚合物中同時引入了具有還原響應(yīng)的二硫鍵和pH響應(yīng)的叔胺基團,其雙功能協(xié)同作用顯著加快了在模擬腫瘤環(huán)境下藥物的釋放速率,10小時藥物釋放量接近60%。此外,星型聚合物四個臂用葉酸分子封端后賦予藥物載體主動靶向能力。激光共聚焦顯微鏡顯示:與修飾前的藥物載體(DOX@BDSP-1)相比,經(jīng)葉酸修飾后,DOX@BDSPF-1的癌細(xì)胞藥物累積率明顯增加(圖3)。
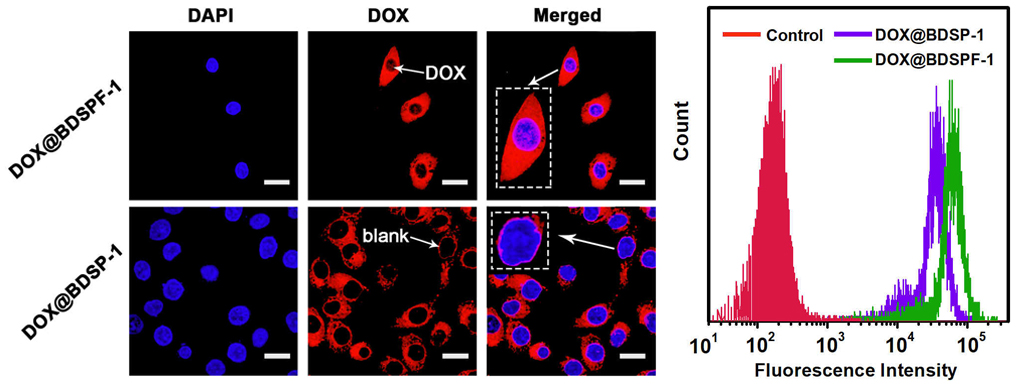
圖3. DOX@BPSPF-1、DOX@BPSP-1的CLSM圖(a)和流式細(xì)胞儀分析結(jié)果(b)。
體外毒性實驗表明:聚合物空膠束在100 mg/L與Hela細(xì)胞共培養(yǎng)48小時后,細(xì)胞存活率仍在90%以上,說明聚合物本身對Hela細(xì)胞無明顯細(xì)胞毒性;而當(dāng)DOX濃度達(dá)到10 mg/L時,DOX@BDSP-1的腫瘤抑制率與純抗癌藥物阿霉素相當(dāng),且經(jīng)葉酸修飾后的DOX@BDSPF-1對癌細(xì)胞的抑制作用比修飾前DOX@BDSP-1顯著增強(圖4)。
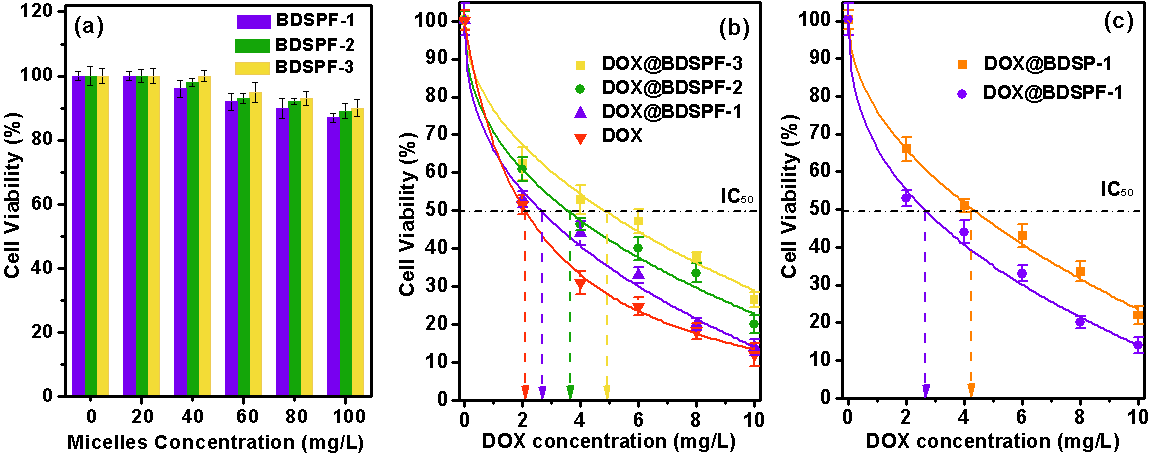
圖4.聚合物空膠束(a)和載藥聚合物膠束DOX@BPSPFs(b)中48小時 Hela細(xì)胞的存活率;葉酸修飾前后載藥聚合物膠束48小時Hela細(xì)胞存活率對比(c)。
該研究成果近期以“Tetraphenylsilane-Cored Star-Shaped Polymer Micelles with pH/ Redox Dual Response and Active Targeting Function for Drug Controlled Release”為題發(fā)表在美國化學(xué)會刊物Biomacromolecules上 (Yingqi Shang, Nan Zheng, Zhonggang Wang*, Biomacromolecules, DOI: 10.1021/acs.biomac.9b01472)。論文的第一作者為大連理工大學(xué)化工學(xué)院博士生尚應(yīng)琦,通訊作者為大連理工大學(xué)王忠剛教授。研究工作得到了國家自然科學(xué)基金委的資助。
- 中國科大陳昶樂/安大陳敏、張文建 Angew:ROMP-RAFT串聯(lián)聚合新方法制備聚烯烴多嵌段共聚物 2025-07-02
- 天津大學(xué)/北京大學(xué) Sci. Adv.:基于光子微球索引的高容量DNA數(shù)據(jù)存儲隨機訪問技術(shù) 2025-06-21
- 青科大李志波/劉紹峰教授團隊 ACS Catal.: 新型鉿金屬催化劑鏈穿梭聚合制備高熔點烯烴嵌段共聚物OBC 2025-05-11
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實現(xiàn)精準(zhǔn)光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團隊 Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細(xì)胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學(xué)思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準(zhǔn)調(diào)控熊果酸螺旋納米纖維原位動態(tài)組裝實現(xiàn)協(xié)同腫瘤增效治療 2025-05-13
- 中科大王育才/蔣為團隊 Nat. Biomed. Eng.: 利用一氧化氮(NO)突破腫瘤血管基底膜屏障,增強納米藥物瘤內(nèi)遞送 2025-05-03
