聯合用藥可以有效克服單一化療藥物治療的缺點,減少癌細胞耐藥性的產生,降低毒副作用,并可以通過不同藥物的協同效應增強治療效果。蛋白藥物具有功能活性高、特異性強、副作用小以及遺傳風險低等優點,將其與化療藥物聯合使用在基礎研究以及臨床評估中已經取得了重要進展。然而,常用的與化療藥物聯合應用的蛋白藥物主要是細胞因子及單克隆抗體等在細胞外發揮功能的蛋白。細胞內發揮抗癌功能的蛋白具有與細胞因子及單克隆抗體不同的抗癌機制,因此,將其與化療藥物聯合使用可以為新型聯合療法的開發提供更多選擇。然而,如何在同一個納米結構中高效共擔載理化性質差異極大的疏水化療藥物和親水蛋白藥物,實現兩種藥物的體內穩定遞送,細胞內的可控釋放,以及蛋白藥物的內涵體/溶酶體逃逸是這兩種藥物共遞送載體開發所面臨的巨大挑戰。
針對以上問題,中國科學院長春應用化學研究所陳學思院士和肖春生副研究員團隊設計、合成了一種含有鄰苯二酚(CA)側基和三級胺(TA)側基的mPEG-b-PGCA-b-PGTA三嵌段共聚物,并將其用于高效共擔載核糖核酸酶A(RNase A)和阿霉素,實現了高效的協同抗腫瘤效果(圖1)。其中,阿霉素(DOX)被包裹在pH響應性的PGTA鏈段,而苯硼酸修飾的RNase A(RNBC)則通過通過苯硼酸鍵共價結合作用擔載在含鄰苯二酚基團的PGCA鏈段,從而形成穩定的載藥納米粒子。當載藥納米粒子進入細胞后,內涵體/溶酶體的酸性微環境促使PGTA鏈段的三級胺側基質子化引起PGTA鏈段親水性增加。同時,鄰苯二酚與苯硼酸的結合作用也在酸性條件下解離,從而實現DOX及RNBC的共同釋放。PGTA鏈段的三級胺側基還具有質子海綿效應,能夠實現RNBC的內涵體/溶酶體逃逸,而逃逸后的RNBC會在DOX介導的癌細胞內高水平ROS的作用下實現苯硼酸基團的去修飾,恢復為天然的RNase A,從而實現高效的協同抗腫瘤作用(圖1)。

圖1. 基于mPEG-b-PGCA-b-PGTA的多級協作納米平臺用于蛋白藥物及小分子化療藥物細胞內共遞送的示意圖
實驗結果表明,mPEG-b-PGCA-b-PGTA可有效共擔載DOX及RNBC,獲得藥物共擔載納米粒子NP-DOX-RNBC(圖2A)。體外藥物釋放實驗結果表明,NP-DOX-RNBC具有可控的酸響應藥物釋放行為,且由于鄰苯二酚與硼酸的共價結合能力強于葡萄糖,生理濃度(10 mM)的葡萄糖不會影響其藥物釋放行為(圖2B和2C)。這表明NP-DOX-RNBC具有較好的生理穩定性,可用于DOX及RNase A的體內穩定共傳輸。共聚焦成像結果表明,NP-DOX-RNBC可將DOX及RNBC共遞送入癌細胞內,其中DOX被遞送入細胞核中,而RNBC被遞送入細胞質中(圖3)。細胞內ROS水平檢測結果表明,NP-DOX-RNBC釋放的DOX顯著提高了細胞內的ROS水平,可促進細胞內RNBC的苯硼酸去修飾,獲得天然的RNase A(圖4A)。細胞活性及細胞凋亡檢測結果表明,NP-DOX-RNBC具有體外協同的抗腫瘤細胞增殖及癌細胞凋亡誘導效果(圖4B和4C)。動物實驗結果表明,NP-DOX-RNBC具有體內協同增強的抗腫瘤效果,且其治療組具有最長的生存時間(圖5)。鑒于動態共價鍵的通用性,該多級協作納米平臺有望進一步應用于其他小分子化療藥物及細胞內活性蛋白藥物組合的細胞內共遞送。
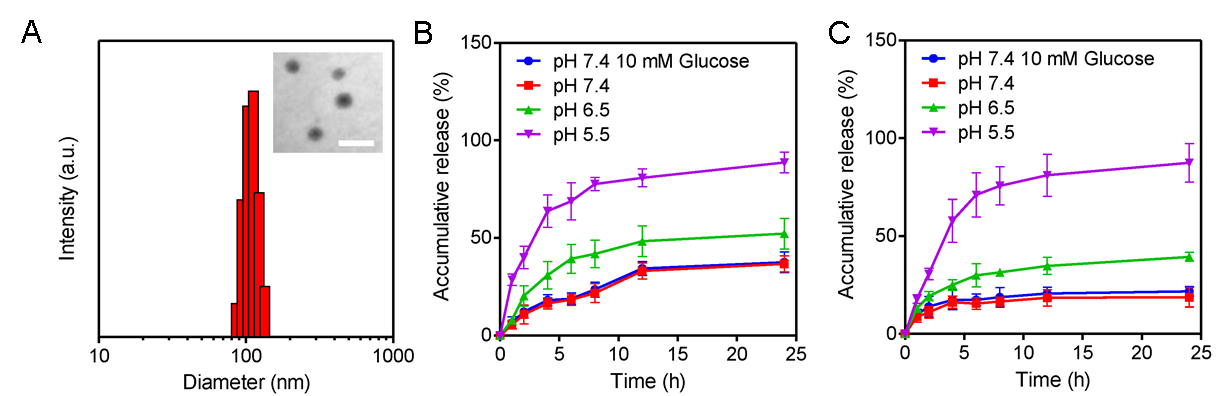
圖2. (A)NP-DOX-RNBC的粒徑及形態;(B)DOX的體外釋放結果;(C)RNBC的體外釋放結果。

圖3. (A)NP-DOX-RNBC介導的細胞內DOX遞送結果;(B)NP-DOX-RNBC介導的細胞內RNBC遞送結果。

圖4. (A)不同藥物處理后的細胞內ROS水平檢測結果;(B)不同納米藥物處理后的細胞活性檢測結果;(C)不同納米藥物處理后的細胞凋亡檢測結果。

圖5. (A)不同藥物治療組的腫瘤生長曲線;(B)不同藥物治療組的相對腫瘤體積;(C)不同藥物治療組的小鼠生存期;(D)不同藥物治療組腫瘤組織的TUNEL檢測結果;(E)不同藥物治療組腫瘤組織的H&E染色結果。
以上研究成果發表在Advanced Materials(10.1002/adma.202000013)上,論文的第一作者為中國科學院長春應用化學研究所助理研究員張鵬,通訊作者為中國科學院長春應用化學研究所陳學思院士及肖春生副研究員。該研究工作得到國家自然科學基金、吉林省科技發展計劃項目以及中國科學院青年創新促進會項目的資助。
原文鏈接:https://doi.org/10.1002/adma.202000013
- 中國科大陳昶樂/安大陳敏、張文建 Angew:ROMP-RAFT串聯聚合新方法制備聚烯烴多嵌段共聚物 2025-07-02
- 天津大學/北京大學 Sci. Adv.:基于光子微球索引的高容量DNA數據存儲隨機訪問技術 2025-06-21
- 青科大李志波/劉紹峰教授團隊 ACS Catal.: 新型鉿金屬催化劑鏈穿梭聚合制備高熔點烯烴嵌段共聚物OBC 2025-05-11
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
