
干細(xì)胞療法在退行性病變和組織損傷修復(fù)中具有較好的應(yīng)用前景。在各種類型的干細(xì)胞中,間充質(zhì)干細(xì)胞(MSC)因其強(qiáng)大的自我更新能力、免疫調(diào)節(jié)能力和旁分泌功能而被視為再生醫(yī)學(xué)的理想種子細(xì)胞。然而,傳統(tǒng)貼壁培養(yǎng)擴(kuò)增后的MSC在臨床應(yīng)用及動(dòng)物實(shí)驗(yàn)中存活率較低,其治療效果達(dá)不到理論高度。這可能是由于體外擴(kuò)增的2D細(xì)胞層與體內(nèi)3D組織體的微環(huán)境相差較大,導(dǎo)致干細(xì)胞衰老、分化和旁分泌能力降低,進(jìn)而使移植的MSC的體內(nèi)保護(hù)作用減弱。由于結(jié)構(gòu)和性能與細(xì)胞外基質(zhì)(ECM)類似,生物材料目前已被廣泛應(yīng)用于干細(xì)胞療法以促進(jìn)移植細(xì)胞的滯留率和存活。盡管模擬ECM的功能性生物材料在開發(fā)中取得了相當(dāng)大的進(jìn)展,但大多數(shù)合成材料仍然缺乏天然ECM所表現(xiàn)出的動(dòng)態(tài)特性。例如,細(xì)胞介導(dǎo)的動(dòng)態(tài)ECM重塑(如纖連蛋白的展開),其在組織結(jié)構(gòu)形成、內(nèi)環(huán)境穩(wěn)態(tài)等基本生理活動(dòng)中發(fā)揮著重要的協(xié)調(diào)作用。利用簡(jiǎn)便的方法設(shè)計(jì)合成生物響應(yīng)性材料誘導(dǎo)3D干細(xì)胞球體仍然是一個(gè)巨大的挑戰(zhàn)。
受此啟發(fā),南方醫(yī)科大學(xué)陳敏生教授和蔡延濱副教授團(tuán)隊(duì)研發(fā)了一種具有生物響應(yīng)性的酶促自組裝多肽(Nap-pD-E7),該多肽由自組裝單元、酶觸發(fā)底物和MSC錨定基序共價(jià)結(jié)合而成。這種酶促自組裝磷酸肽能夠靶向錨定于MSC細(xì)胞表面,隨后它在細(xì)胞間隙被堿性磷酸酶去磷酸化,以此提供一個(gè)動(dòng)態(tài)轉(zhuǎn)變的微環(huán)境來(lái)自組裝形成納米纖維結(jié)構(gòu)。這種原位自組裝納米纖維能夠增強(qiáng)細(xì)胞-ECM和細(xì)胞-細(xì)胞粘附力并誘導(dǎo)MSC形成3D細(xì)胞球體(圖1)。進(jìn)一步的研究表明,細(xì)胞間的組裝體和ECM分子的相互作用增強(qiáng)了纖維粘附,并且MSC細(xì)胞球體的形成激活了細(xì)胞HIF-1α信號(hào)通路,繼而增強(qiáng)MSC的旁分泌功能,促進(jìn)血管新生。最后,通過構(gòu)建仿生組織修復(fù)體系,評(píng)估了該仿生系統(tǒng)在小鼠心肌梗死模型中的治療效果。目前,這一研究成果已發(fā)表于期刊Chemical Engineering Journal上,題目為“Enzymatic self-assembly nanofibers anchoring mesenchymal stem cells induce cell spheroids and amplify paracrine function for myocardial infarction therapy”,碩士研究生范祥霖、戰(zhàn)捷博士為第一作者,陳敏生教授、蔡延濱副教授為通訊作者。該研究得到了國(guó)家自然科學(xué)基金、廣東省基礎(chǔ)和應(yīng)用基礎(chǔ)研究基金和中國(guó)博士后科學(xué)基金創(chuàng)新支持計(jì)劃的支持。
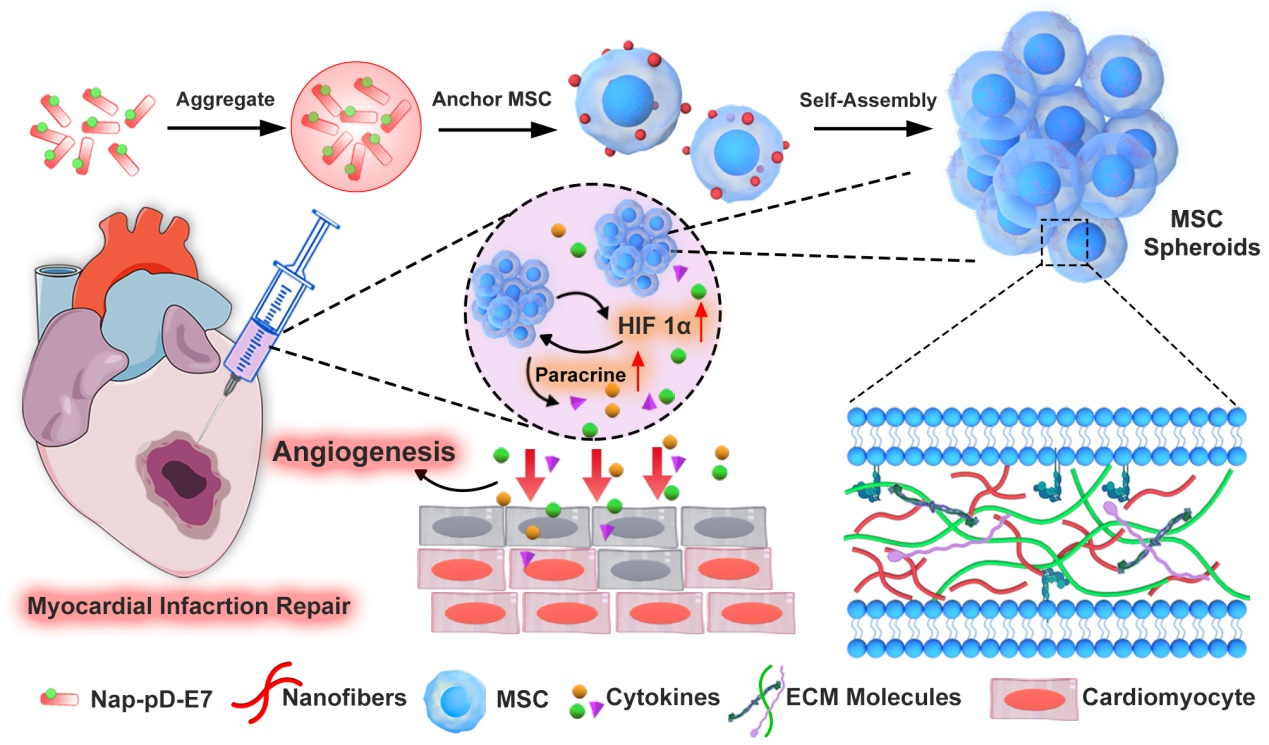
圖1: Nap-pD-E7誘導(dǎo)MSC球體的形成及其在小鼠心肌梗死治療中的應(yīng)用。
【本文要點(diǎn)】
(1)設(shè)計(jì)與合成具有生物響應(yīng)性的酶促自組裝多肽Nap-pD-E7
利用固相合成法合成Nap-pD-E7,通過流變,透射電鏡和圓二色譜等方法對(duì)材料的組裝性能進(jìn)行表征。
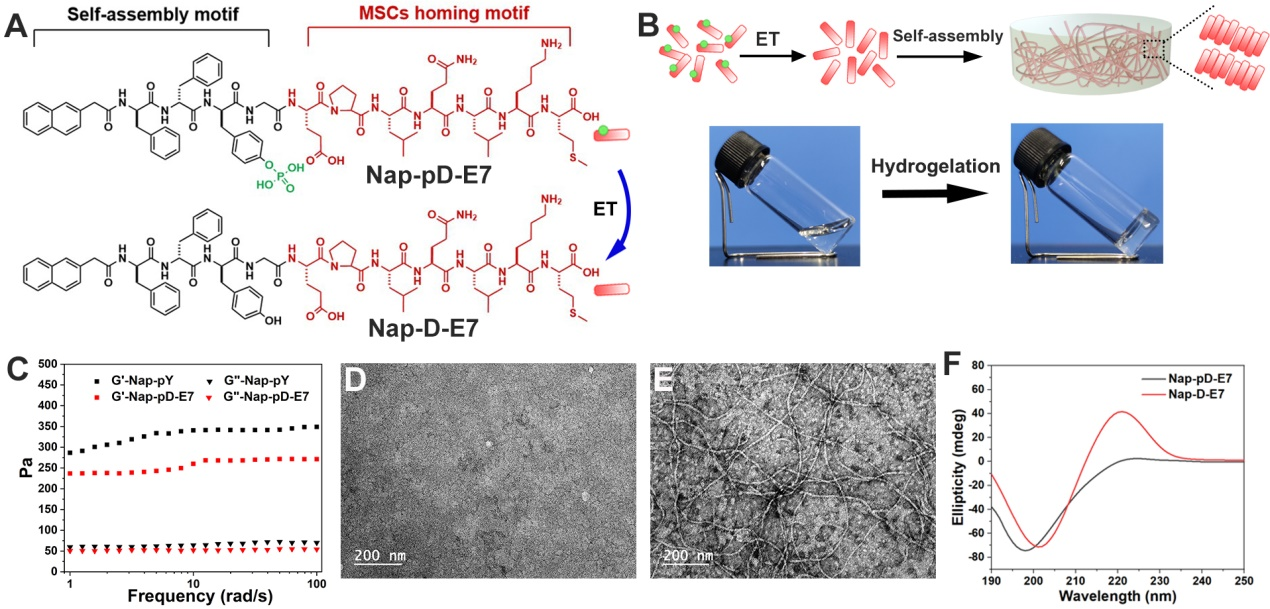
圖2:Nap-pD-E7的設(shè)計(jì)合成及表征。
(2)MSC細(xì)胞球體的形成及相關(guān)機(jī)制研究
Nap-pD-E7可以通過與內(nèi)源性ECM分子相互作用誘導(dǎo)MSC形成細(xì)胞球體,并且磷酸化-去磷酸化這一動(dòng)態(tài)轉(zhuǎn)化過程和E7靶向序列對(duì)細(xì)胞球體的形成至關(guān)重要。

圖3:MSC細(xì)胞球體的形成及Nap-pD-E7材料與ECM分子的共定位。
(3)MSC細(xì)胞球體的形成對(duì)細(xì)胞旁分泌功能的影響
通過qPCR、WB和免疫熒光等實(shí)驗(yàn)研究細(xì)胞球體的旁分泌功能。與對(duì)照組相比,細(xì)胞球體形成后MSC的旁分泌功能有所增強(qiáng),特別是促血管生長(zhǎng)相關(guān)因子,這一細(xì)胞功能的改變與HIF-1α信號(hào)通路的激活有關(guān)。

圖4:MSC細(xì)胞球體旁分泌功能的增強(qiáng)及相關(guān)機(jī)制探討。
(4)仿生組織修復(fù)體系對(duì)心梗小鼠心臟功能的影響
由于MSC細(xì)胞球體旁分泌功能的增強(qiáng)有助于缺血損傷組織的修復(fù),因此構(gòu)建了Nap-pD-E7水凝膠包裹MSC細(xì)胞球體的仿生移植體系。在相關(guān)動(dòng)物實(shí)驗(yàn)中,該仿生系統(tǒng)的移植明顯減輕了心肌梗死后心臟功能的惡化。

圖5:仿生移植體系的構(gòu)建及其在小鼠心肌梗死治療中的應(yīng)用。
(5)仿生組織修復(fù)體系對(duì)心梗小鼠心臟重構(gòu)和血管新生的影響。
通過心臟組織切片染色研究該仿生體系對(duì)心梗小鼠心室重構(gòu)和梗死周邊區(qū)域血管新生的影響。結(jié)果表明,Nap-pD-E7水凝膠包裹MSC細(xì)胞球的移植能減輕心梗后左心室膠原沉積和不良肥大,同時(shí)促進(jìn)梗死周邊區(qū)小血管的新生,以保留更多的心肌細(xì)胞。
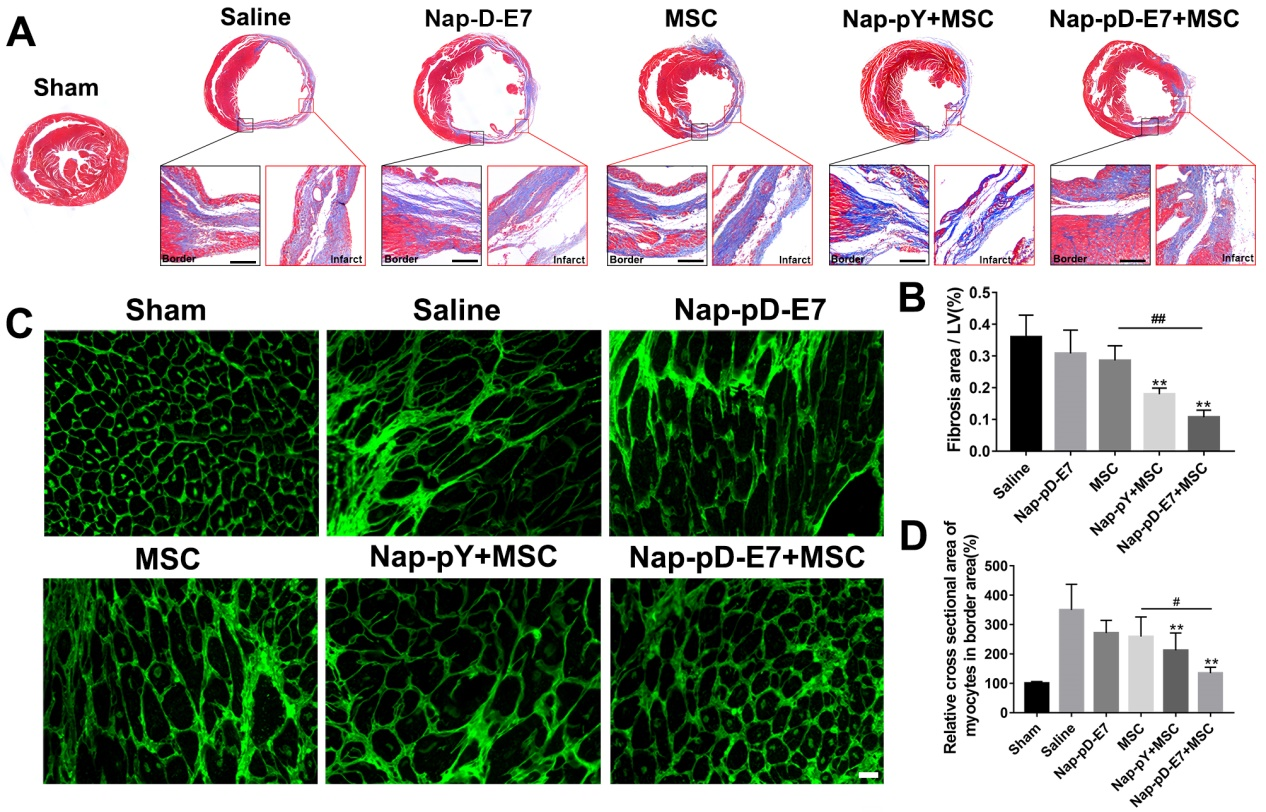
圖6:心肌梗死后心室重構(gòu)的變化。

圖7:心肌梗死周邊區(qū)域小血管新生情況。
文章鏈接:https://doi.org/10.1016/j.cej.2022.135224
通訊作者簡(jiǎn)介
陳敏生教授:二級(jí)教授,博導(dǎo),國(guó)務(wù)院特殊津貼專家,主要從事心血管疾病臨床與發(fā)病機(jī)制研究、心血管組織工程、藥物釋放等研究。長(zhǎng)期致力于可注射功能化水凝膠體系制備及其對(duì)微環(huán)境調(diào)控,功能化水凝膠在細(xì)胞三維培養(yǎng)、藥物傳輸與緩釋、干細(xì)胞移植、心肌修復(fù)等領(lǐng)域的研究,以通訊作者在Adv. Sci., Biomaterials, Theranostics, ACS Appl. Mater. Interfaces, ATVB等學(xué)術(shù)期刊上發(fā)表一系列研究成果。先后主持承擔(dān)國(guó)家“863計(jì)劃”子項(xiàng)目2項(xiàng)、國(guó)家自然科學(xué)基金(含重點(diǎn)項(xiàng)目1項(xiàng))6項(xiàng)、廣東省科技計(jì)劃項(xiàng)目5項(xiàng)、廣東省自然科學(xué)基金項(xiàng)目3項(xiàng)、廣州市科技計(jì)劃項(xiàng)目(含市教育局創(chuàng)新團(tuán)隊(duì)項(xiàng)目)7項(xiàng),橫向課題和院級(jí)課題各1項(xiàng)。國(guó)家發(fā)明專利6項(xiàng),主編專著3部:《疾病診斷治療常規(guī)》(廣東高教出版社出版,120萬(wàn)字)、《心血管病學(xué)前沿--基礎(chǔ)與臨床》(廣東科技出版社,118萬(wàn)字)及《生命救助手冊(cè)》。獲教育部科技進(jìn)步二等獎(jiǎng)、廣東省科技進(jìn)步二等獎(jiǎng)、廣州市科技進(jìn)步二等獎(jiǎng)各2項(xiàng),廣東省教育廳科技進(jìn)步三等獎(jiǎng)、廣州市科技進(jìn)步三等獎(jiǎng)各1項(xiàng)。擔(dān)任國(guó)家科學(xué)技術(shù)獎(jiǎng)評(píng)審專家,國(guó)家自然科學(xué)基金委員會(huì)同行評(píng)議專家,全國(guó)高等醫(yī)學(xué)教材建設(shè)指導(dǎo)委員會(huì)理事,廣東省醫(yī)學(xué)會(huì)心血管病分會(huì)副主任委員,廣東省醫(yī)學(xué)會(huì)健康管理學(xué)分會(huì)主任委員、《南方醫(yī)科大學(xué)學(xué)報(bào)》主編。
蔡延濱副教授:碩士生導(dǎo)師,廣東省藥理學(xué)會(huì)心血管專委會(huì)常委,廣東省病生學(xué)會(huì)心血管青年委員會(huì)委員,主要從事小分子多肽水凝膠體系及其生物醫(yī)學(xué)應(yīng)用的研究,具體包括:基于自組裝多肽的新型抗癌納米藥物;多肽自組裝的納米熒光探針的構(gòu)建及其在生物檢測(cè)中的應(yīng)用;多肽自組裝材料及生物相容性水凝膠材料在心血管疾病中的應(yīng)用,以第一或通訊作者在J. Am. Chem. Soc., Angew. Chem. Int. Ed., Biomaterials, Theranostics, ACS Appl. Mater. Interfaces, Anal. Chem., Chem. Commun., Nanoscale等學(xué)術(shù)期刊上發(fā)表SCI論文20余篇。主持國(guó)家自然科學(xué)基金2項(xiàng),廣東省自然科學(xué)基金2項(xiàng)。
- 四川大學(xué)丁明明教授/付維力教授《Nat. Commun.》:生物響應(yīng)和生物活性多色熒光高分子 2024-11-24
- 四川大學(xué)林云鋒教授課題組《Adv. Mater.》: “太陽(yáng)神鳥”啟發(fā)的基于四面體框架核酸的生物響應(yīng)性miRNA遞送系統(tǒng) 2022-08-01
- 新加坡國(guó)立大學(xué)熊澤博士和John S. Ho教授團(tuán)隊(duì)《Sci. Adv.》:基于DNA水凝膠的無(wú)線、柔性傷口感染監(jiān)測(cè)器件 2021-11-23
- 同濟(jì)大學(xué)杜建忠/范震團(tuán)隊(duì)《Adv. Funct. Mater.》:酶促自組裝多肽納米顆粒治療細(xì)菌性感染傷口 2023-03-13
- 中國(guó)農(nóng)業(yè)科學(xué)院麻類研究所侯春生研究員團(tuán)隊(duì) ACS Nano:黃麻納米纖維素精準(zhǔn)調(diào)控腸道菌群,重建微塑料損傷的腸道微生態(tài)平衡 2025-07-04
- 蘇大程絲教授/福大賴躍坤教授/安農(nóng)大朱天雪教授 NML 綜述:用于監(jiān)測(cè)物理、生理信號(hào)和體液信號(hào)的電紡納米纖維基復(fù)合材料的最新進(jìn)展 2025-06-20
- 天津工業(yè)大學(xué)林童教授團(tuán)隊(duì) AFM:仿生彎曲狹縫結(jié)構(gòu)開發(fā)高性能納米纖維聲電器件 2025-06-02
