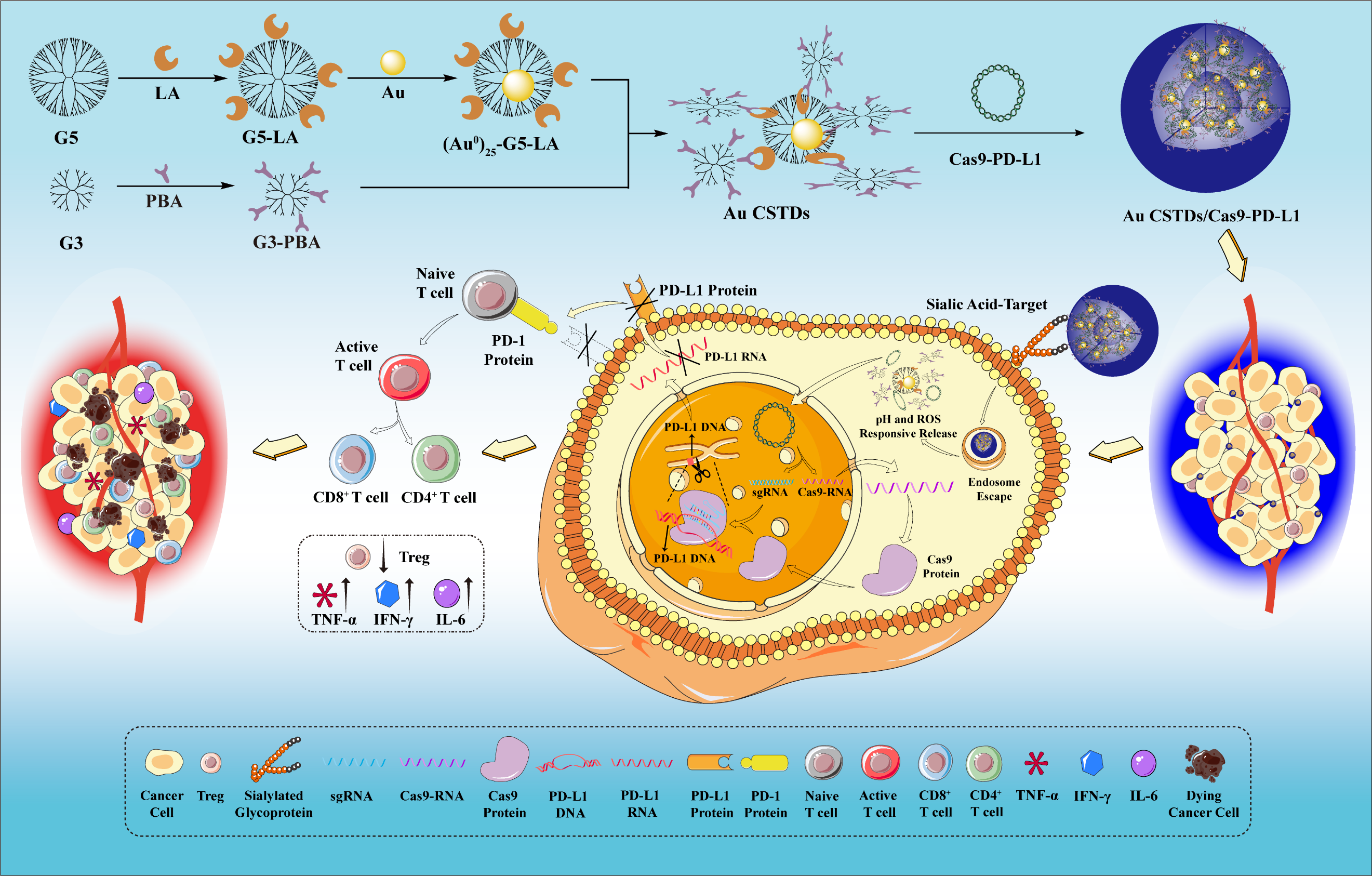
免疫檢查點阻斷(ICB)療法通過激活免疫系統來抑制腫瘤的發生和轉移,已成為一種極具前景的治療策略。在眾多的檢查點中,程序性死亡配體1(PD-L1)被認為是腫瘤相關免疫抑制和腫瘤進展的關鍵調節因子,已被用作臨床治療實體腫瘤的治療靶點。目前,常用單克隆抗體或小干擾RNA(siRNA)來阻斷PD-L1/PD-1通路,但存在耐久性差、免疫反應低等問題。因此,永久性、特異性地抑制腫瘤細胞中PD-L1基因的表達,有望實現更有效、更持久ICB治療。
作為一種前沿的基因組編輯工具,聚類規則穿插短回文重復序列(CRISPR)-相關蛋白9(CRISPR/Cas9)系統為癌癥的治療提供了新的思路。CRISPR/Cas9具有精確高效的基因編輯能力,能夠在sgRNA的引導下識別特定的DNA序列,并通過Cas9核酸內切酶切割目標PD-L1基因,調控腫瘤細胞PD-L1的表達。在腫瘤治療中,基于質粒的CRISPR/Cas9系統因其結構簡單、成本低、整合效率高而被廣泛應用。提高靶標特異性和基因編輯效率是CRISPR/Cas9系統在免疫治療中的關鍵,因此迫切需要開發靶向腫瘤和響應性的納米載體,以精確和有效地在腫瘤細胞內傳遞CRISPR/Cas9質粒。
研究團隊通過1H NMR、UV-vis和2D NOESY證明了金納米顆粒的成功包裹以及核殼樹狀大分子的成功構建(圖2A-C)。TEM、AFM以及水合粒徑分布圖顯示出Au CSTDs呈球形,且大小均一(圖2D-F)。Au CSTDs的紅細胞溶血率低于5%,具有良好的血液相容性。此外,通過熒光光譜分析驗證了苯硼酸酯鍵在低pH和高H2O2的響應性斷裂,這將導致Au CSTDs在腫瘤微環境下發生pH和H2O2響應性分解(圖2H和I)。

圖2. (A) (Au0)25-G5-LA、G3-PBA和Au CSTDs的1H NMR譜。(B) G5-LA、(Au0)25-G5-LA和Au CSTDs的紫外-可見光譜。(C) Au CSTDs的2D NOESY光譜。(D) Au CSTDs的TEM圖像和大小分布直方圖。(E)AFM圖像和Au CSTDs的高度輪廓。(F)各物質在水中的水合粒徑圖。(G)不同濃度的Au CSTDs對小鼠的溶血率。陽性對照為1%的Triton X-100 (TX-100),陰性對照為PBS。插圖顯示了與材料共孵育2小時離心后的照片。(H) Au CSTDs在pH為7.4、6.4和5.4時的熒光激發光譜。(I) Au CSTDs在含H2O2 (0.1 mM) pH = 7.4的熒光激發光譜。所有激發光譜均使用388 nm的發射波長。PBA的濃度固定在1 mM。

圖3. (A) Cas9-PD-L1質粒和靶向PD-L1的sgRNA序列。(B)不同N/P比下, Au CSTDs壓縮Cas9-PD-L1質粒的瓊脂糖凝膠阻滯試驗。1:DNA Marker (5000 bp);2:游離Cas9-PD-L1;3?8:N/P比分別為0.125、0.25、0.5、1、2和5。(C) N/P = 10時,在不同環境下Au CSTDs壓縮Cas9-PD-L1質粒的瓊脂糖凝膠阻滯試驗。(D)不同N/P比下Vector/Cas9-PD-L1的水合粒徑。(E)不同載體濃度的Vector、Vector/Cas9-PD-L1和Vector/ Cas9-NC處理的B16-F10細胞24小時的活力測定。Cas9-NC質粒中的sgRNA被無序DNA取代。(F)在N/P分別為2、5、10、15、20和30時,PBS、Cas9-PD-L1和Vector/Cas9-PD-L1轉染B16-F10細胞后的代表性流式細胞儀圖和(G)相對平均熒光強度。

研究團隊進一步驗證了Au CSTDs遞送CRISPR-Cas9系統的作用機制。T7核酸內切酶I證實了該系統有效的基因編輯能力,它可以在DNA水平上顯著降低PD-L1基因。值得注意的是,用Au CSTDs作為載體遞送系統,比游離Cas9-PD-L1的對照組基因編輯效率增加了7.1倍(圖5A)。RT-PCR以及WB實驗證明,CRISPR-Cas9系統可以進一步降低PD-L1基因的RNA水平以及蛋白質水平(圖5B和C)。
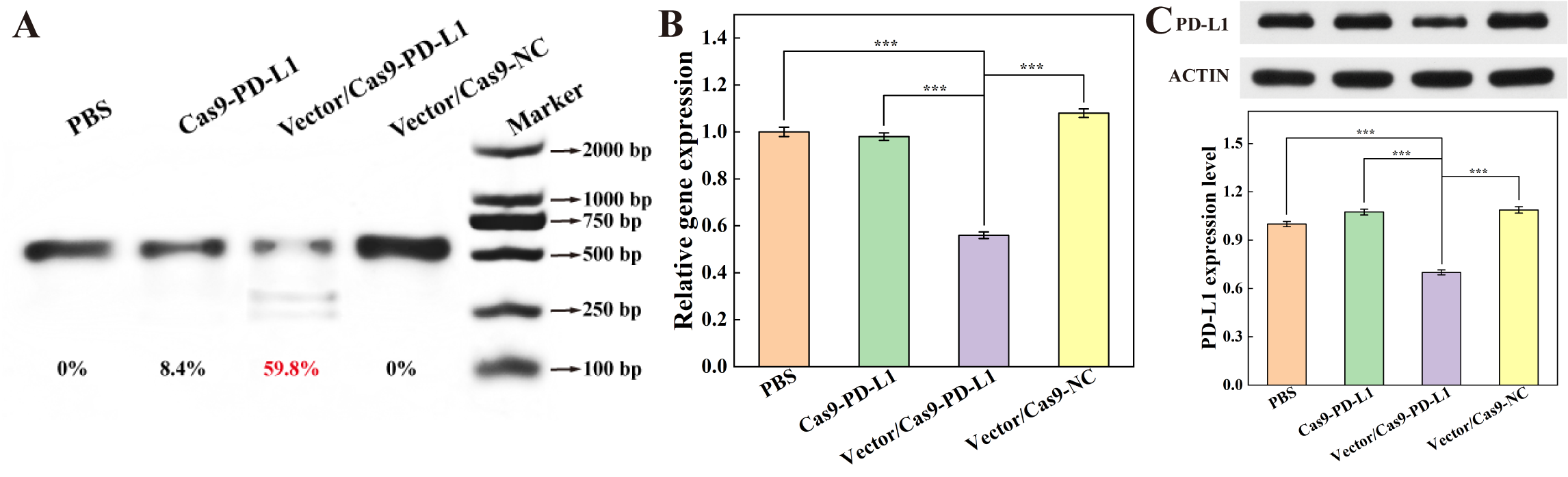
圖5. (A) PD-L1基因組位點的T7EI檢測,(B) PD-L1基因表達的RT-PCR檢測,(C) PBS、Cas9-PD-L1、Vector/Cas9-PD-L1和Vector /Cas9-NC轉染后PD-L1蛋白表達的WB檢測。在(B)和(C)中,PBS處理的細胞表達量設為1.0。

圖6. (A)不同濃度的Au CSTDs和碘海醇中Au或I的的CT圖像和HU值。(B) B16-F10腫瘤模型瘤周注射Au CSTDs([Au] = 5 mM)后,不同時間間隔的CT圖像和HU值。腫瘤區域用紅色圈出。(D)瘤周注射Au CSTDs后,小鼠主要器官和腫瘤在不同時間的Au含量的生物分布。

圖7. (A)體內腫瘤免疫治療的示意圖及時間軸。小鼠的(B)相對腫瘤體積變化、(C)分離腫瘤的照片和重量以及(D)不同治療組的體重變化。每組6只小鼠。(E)第12天B16-F10腫瘤組織的H&E、TUNEL和Ki-67染色圖片。比例尺:50 μm。(F)腫瘤切片中TUNEL陽性細胞和Ki-67陽性細胞的百分比。

圖8. (A)腫瘤組織中PD-L1蛋白表達的圖像和定量分析。PBS處理的腫瘤組織中PD-L1的表達設置為1.0。(B)腫瘤組織中PD-L1蛋白、CD4和CD8 T細胞的免疫熒光染色。比例尺:50 μm。脾臟中T細胞的流式細胞術分析。(C) CD4+/CD8+ T細胞和CD4+CD25+FOXP3+ T細胞(Tregs)的點圖。(D) CD4+和(E) CD8+ T細胞的比例和(F) Tregs的比例。(G)第12天血清中TNF- α、(H) IFN-γ和(I) IL-6的定量分析。
簡言之,研究團隊設計的pH和H2O2敏感的Au CSTD納米材料可以壓縮和響應性釋放CRISPR/Cas9質粒,通過永久性和特異性地破壞腫瘤細胞中PD-L1的表達,實現ICB治療。Au CSTDs/Cas9-PD-L1通過靶向過表達唾液酸被腫瘤細胞特異性攝取,隨著苯硼酸酯鍵的斷裂Cas9-PD-L1被響應性釋放出來,并定位于細胞核有效地切割PD-L1基因。體內實驗證明,Au CSTDs/Cas9-PD-L1系統可以特異性聚集于腫瘤實現增強的CT成像,顯著降低腫瘤細胞的PD-L1表達、誘導CD4+/CD8+ T細胞分布增加、減少免疫抑制細胞比例、上調細胞因子TNF-α/IFN-γ/IL-6,表現出顯著的腫瘤抑制效果。因此,本研究制備的Au CSTD納米材料為遞送CRISPR/Cas9質粒用于ICB治療提供了新的思路。
文章鏈接:https://pubs.acs.org/doi/10.1021/acsami.2c22584
- 東華大學史向陽團隊 ACS Nano:纖連蛋白包覆的金屬-多酚網絡通過鐵死亡增強的ICD實現腫瘤的化學/化學動力學/免疫協同治療 2022-01-19
- 東華大學郭睿教授/史向陽教授課題組 Acta Biomater.:仿生納米平臺介導的缺氧-腺苷軸破壞和PD-L1敲除用于增強MRI引導的化學動力學/免疫治療 2025-06-27
- 深大附屬華南醫院馬婧、法國CNRS彭玲團隊 AM: PD-L1抗體偶聯PAMAM樹形分子納米體系抑制癌癥糖酵解和促進免疫應答 2023-12-17
- 川大高會樂/曹俊 Adv. Sci.綜述:PD-L1在癌癥治療中的空間異質性表達行為 - 挑戰與機遇并存 2023-11-12
- 安理工王文新團隊 ACS Nano: 富含胍基的聚β氨基酯用于功能性胞質蛋白遞送和基于 CRISPR/Cas9 RNP的基因編輯 2023-09-13
- 華中大羅亮教授/同濟醫院田德安教授聯合團隊 ACS Nano:口服仿生細菌鞭毛的納米纖維用于炎癥性腸病的靶向CT成像與治療 2023-02-20
- 華中大羅亮教授團隊 Nat. Commun.:基于共軛高分子的新型高效CT對比劑助力腫瘤精準診療 2022-05-14
