導(dǎo)致癌癥治療失敗的主要原因之一是腫瘤細(xì)胞通過血管和淋巴管的廣泛轉(zhuǎn)移。近年來,腫瘤血管阻斷療法、光熱治療(PTT)和免疫治療等新策略在癌癥治療中取得了顯著進(jìn)展。然而,這些單一的治療模式由于無法在抑制原發(fā)性腫瘤生長的同時抑制腫瘤轉(zhuǎn)移,其效果不盡如人意。開發(fā)能夠同時抑制腫瘤生長和轉(zhuǎn)移的納米平臺仍然是一個嚴(yán)峻的挑戰(zhàn)。
以血管阻斷劑5,6-二甲基黃嘌呤-4-乙酸(DMXAA)為代表的血管阻斷療法雖然能夠引起腫瘤中心組織出血性壞死并激活免疫系統(tǒng),但是仍無法有效根除整個實體腫瘤。鑒于PTT可以有效殺傷腫瘤外周細(xì)胞,并且PTT誘導(dǎo)的免疫原性細(xì)胞死亡和DMXAA起到的免疫調(diào)節(jié)作用可能共同激活體內(nèi)抗腫瘤免疫響應(yīng),將PTT與血管阻斷療法結(jié)合可能是一種增強(qiáng)且互補(bǔ)的策略。
近期,東華大學(xué)曹雪雁副研究員/史向陽教授團(tuán)隊構(gòu)建了一種智能型樹狀大分子納米平臺用于免疫調(diào)節(jié)介導(dǎo)的聯(lián)合光熱/血管阻斷療法。研究團(tuán)隊首先在第五代聚酰胺-胺樹狀大分子的表面修飾聚乙二醇化的靶向肽LyP-1,接著先后在其內(nèi)部空腔中負(fù)載硫化銅納米顆粒(CuS NPs)和DMXAA,得到智能型樹狀大分子納米平臺G5-PEG-LyP-1-CuS-DMXAA NPs(GLCD NPs)(圖1)。
材料表征結(jié)果表明,所合成的GLCD NPs尺寸均一,具有良好的單分散性、膠體穩(wěn)定性、光熱穩(wěn)定性、高光熱轉(zhuǎn)換效率(59.3%)和pH敏感的藥物釋放性能(圖2)。體外細(xì)胞實驗結(jié)果表明,GLCD NPs具有優(yōu)異的體外靶向能力、光熱消融能力和免疫激活能力(圖3,4)。體內(nèi)動物實驗結(jié)果表明,GLCD NPs可以通過靶向PTT殺傷腫瘤,同時破壞腫瘤血管和淋巴管以防止肺轉(zhuǎn)移,PTT誘導(dǎo)的免疫原性細(xì)胞死亡和DMXAA介導(dǎo)的免疫調(diào)節(jié)在體內(nèi)協(xié)同激活了抗腫瘤免疫響應(yīng)(圖5,6)。
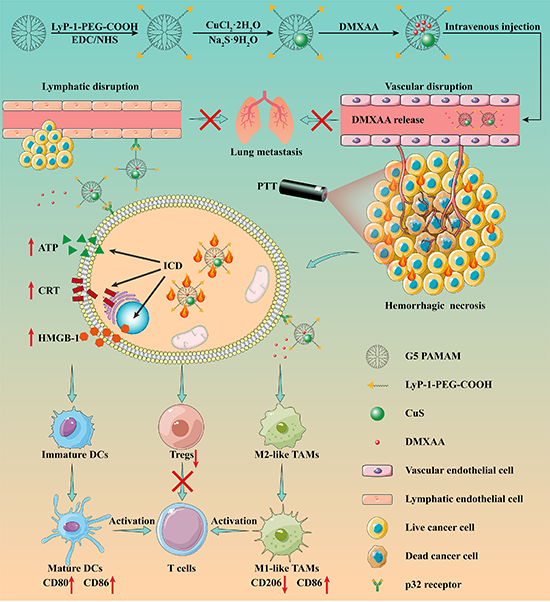

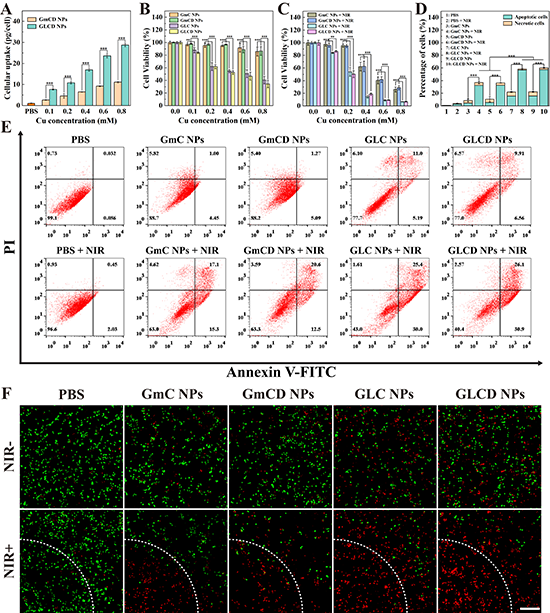
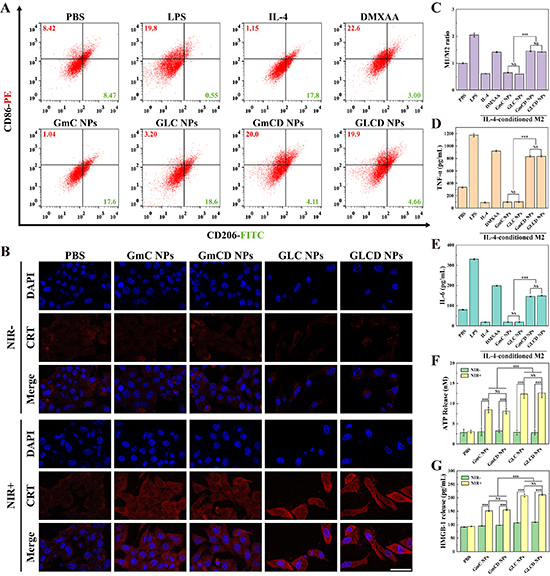


圖6 經(jīng)過不同治療后第2天腫瘤切片的(A)CD31染色和(B)LYVE-1染色,標(biāo)尺為100 μm;(C)經(jīng)過不同治療后第18天小鼠肺部的照片和(D)對應(yīng)的H&E染色,標(biāo)尺為5 mm。
論文鏈接:https://doi.org/10.1002/smll.202301914
- 清華謝續(xù)明教授課題組 ACS Nano:由MXene納米片促進(jìn)構(gòu)筑的高強(qiáng)韌、超拉伸、高導(dǎo)電和智能型多重鍵網(wǎng)絡(luò)物理水凝膠 2021-12-30
- “智能型生物可吸收導(dǎo)電高分子納米復(fù)合材料與電刺激定向誘導(dǎo)組織再生”技術(shù)獲重要進(jìn)展 2011-07-29
- 東華大學(xué)沈明武研究員/史向陽教授團(tuán)隊:不對稱含磷樹狀大分子遞送菠蘿蛋白酶用于骨關(guān)節(jié)炎的抗炎和軟骨保護(hù)治療 2025-06-13
- 東華大學(xué)史向陽教授團(tuán)隊:外泌體包裹的響應(yīng)性樹狀大分子納米凝膠可實現(xiàn)急性肺損傷的免疫調(diào)節(jié)和抗氧化聯(lián)合治療 2025-05-15
- 東華大學(xué)沈明武/史向陽團(tuán)隊《Acta Biomater.》:含磷樹狀大分子介導(dǎo)的生物礦化用于協(xié)同的腫瘤阻斷治療與乏氧激活化療 2025-04-28
- 東南大學(xué)葛麗芹教授團(tuán)隊 CEJ 綜述:具有免疫調(diào)節(jié)特性的工程化微膠囊在癌癥、炎癥和自身免疫中的應(yīng)用 2025-04-09
- 四川大學(xué)楊佼佼副研究員、王端副教授、周宗科教授 CEJ:超聲激發(fā)的工程化益生菌胞外囊泡涂層用于抗植入體感染和免疫調(diào)節(jié) 2024-12-30
