青農(nóng)大孔曉穎、康復(fù)大學(xué)師進(jìn)生/周祺惠 AFM:激活的免疫系統(tǒng)通過抑制腫瘤相關(guān)成纖維細(xì)胞左右光療的體內(nèi)抗腫瘤效果
實(shí)體腫瘤微環(huán)境(TME)通常被大量免疫抑制的腫瘤相關(guān)成纖維細(xì)胞浸潤,導(dǎo)致大多數(shù)腫瘤持續(xù)處于免疫“冷”狀態(tài)。近十年來,光療抗腫瘤研究證實(shí),光熱和光動力提供的熱消融、活性氧/活性氮等自由基可促進(jìn)腫瘤相關(guān)抗原的分泌,促進(jìn)細(xì)胞氧化損傷,上調(diào)免疫原性細(xì)胞死亡和細(xì)胞熱凋亡。因此,光療與免疫治療的有效結(jié)合有望實(shí)現(xiàn)抗腫瘤治療效果的協(xié)同放大。然而,通過熱消融以及光療中活性分子激活的免疫系統(tǒng)是否直接參與腫瘤細(xì)胞的攻擊還需要進(jìn)一步的證據(jù)證實(shí)。為了揭示光療過程中免疫系統(tǒng)的抗腫瘤作用,有必要從TME相關(guān)的角度探討激活的免疫系統(tǒng)是否直接參與光療的抗腫瘤治療過程。

近日,青島農(nóng)業(yè)大學(xué)孔曉穎副教授聯(lián)合康復(fù)大學(xué)師進(jìn)生教授/周祺惠研究員開發(fā)了一種NO/RNS輔助的光療納米平臺(MCH-OBN),以研究免疫激活在光療抗腫瘤效果中的決定性作用及其具體機(jī)制。作者利用黑色素(MNP)偶聯(lián)光敏劑Ce6并包裹透明質(zhì)酸(HA),獲得光熱(PTT)/光動力(PDT)治療載體MCH納米顆粒。同時,活性氧(ROS)響應(yīng)的白芨多糖-PBAP復(fù)合物負(fù)載NO供體,獲得OBN膠囊,由此實(shí)現(xiàn)NO/RNS輔助的PTT/PDT腫瘤靶向治療(圖1)。野生型小鼠和免疫缺陷小鼠的抗腫瘤效果比較表明,MCH-OBN平臺提供的有效光療在體內(nèi)不能獨(dú)立殺死腫瘤細(xì)胞,其作用明顯依賴于免疫激活。此外,激活的免疫系統(tǒng)被證明通過抑制癌癥相關(guān)成纖維細(xì)胞(CAFs)的生長來破壞腫瘤細(xì)胞的“屏障保護(hù)”,確保熱消融、ROS和其他光療成員對腫瘤的有效損傷。因此,本工作首次揭示了免疫激活通過調(diào)節(jié)CAFs增殖來決定光療抗腫瘤效果的生物學(xué)機(jī)制,這對優(yōu)化光療抗腫瘤臨床治療具有重要意義。

圖1. 不同免疫狀態(tài)下MCH-OBN光療納米平臺抗腫瘤效果示意圖。
作者通過一系列手段證明了MCH-OBN平臺的制備成功并驗(yàn)證其具有良好的光熱動力效果(圖2)。在本研究中,MCH + OBN + Laser對體外4T1細(xì)胞造成的嚴(yán)重氧化損傷以及光熱損傷(圖3)上調(diào)腫瘤免疫原性死亡(ICD)通路(圖4)并進(jìn)一步誘導(dǎo)樹突細(xì)胞(DCs)的成熟和抗原提呈。初步的體外實(shí)驗(yàn)結(jié)果證實(shí)了MCH-OBN納米平臺的免疫激活能力,這為后續(xù)免疫依賴性研究的成功開展提供了良好的光療載體。

圖2. MCH-OBN納米平臺的表征
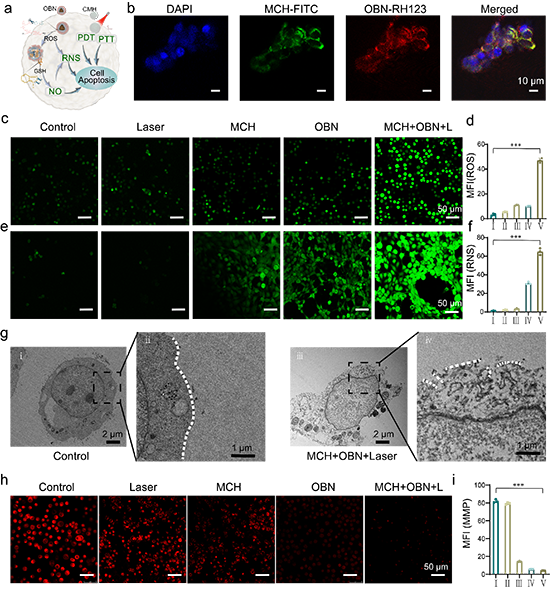
圖3. 納米顆粒的細(xì)胞攝取以及對細(xì)胞損傷

圖4. MCH-OBN納米平臺體外抗腫瘤分析及DCs成熟
野生型小鼠和免疫缺陷小鼠的體內(nèi)抗腫瘤效果比較(圖5和圖6)證明,MCH-OBN平臺提供的光療抗腫瘤作用密切依賴于免疫激活,提示免疫系統(tǒng)可能不僅直接殺死腫瘤細(xì)胞,還可能參與其他途徑來決定抗腫瘤光療策略的有效性。為了證實(shí)CAFs在調(diào)節(jié)光療抗腫瘤作用中的決定性作用,該研究進(jìn)一步采用流式細(xì)胞術(shù)從4T1荷瘤小鼠腫瘤單細(xì)胞懸液中分離出CD45-/CD31-/FAP+腫瘤相關(guān)成纖維細(xì)胞(圖7),證明了激活的免疫系統(tǒng)通過抑制CAFs的增殖和破壞細(xì)胞外屏障來增強(qiáng)光療的抗腫瘤功效。然而,當(dāng)將光療應(yīng)用于免疫缺陷的載瘤小鼠時,免疫細(xì)胞的缺乏導(dǎo)致CAF過度增殖和細(xì)胞外屏障穩(wěn)定,這種增強(qiáng)的免疫“冷”狀態(tài)進(jìn)一步隔離了光療載體在腫瘤組織中的滲透和細(xì)胞殺傷。

圖5. 野生型小鼠體內(nèi)抗腫瘤治療及免疫分析

圖6. NOD-SCID小鼠體內(nèi)抗腫瘤治療及免疫分析
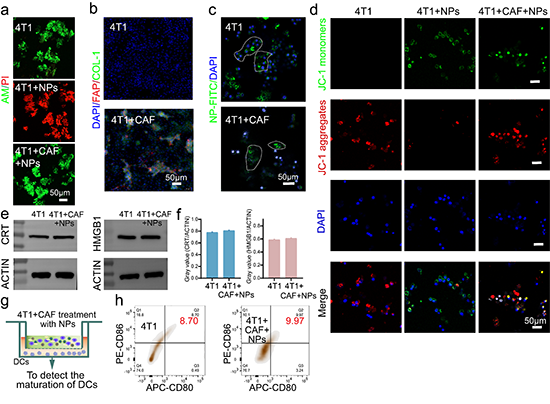
圖7.調(diào)控光療抗腫瘤機(jī)制的CAFs體外分析
為了證實(shí)光療過程中CAFs對4T1細(xì)胞的保護(hù)作用,在相同的MCH-OBN納米平臺處理后,與CAFs共培養(yǎng)的4T1細(xì)胞以及未共培養(yǎng)4T1細(xì)胞進(jìn)行了轉(zhuǎn)錄組分析(圖8和圖9)。通過KEGG和GO富集分析表明,這些差異表達(dá)基因與多種細(xì)胞凋亡/免疫激活/膠原形成/細(xì)胞外基質(zhì)等信號通路相關(guān),這提供了CAFs促進(jìn)腫瘤細(xì)胞外基質(zhì)分泌,抑制腫瘤免疫微環(huán)境的證據(jù)。4T1細(xì)胞和與CAFs共培養(yǎng)的4T1細(xì)胞對光療反應(yīng)的細(xì)胞和遺傳行為的差異表明,免疫“冷”腫瘤中CAFs的豐度在光療過程中,組織不僅阻礙了熱傳導(dǎo)和活性小分子對腫瘤細(xì)胞的攻擊,而且顯著抑制了隨后的免疫激活。相反,在免疫“熱”的腫瘤組織中,高度活化的免疫成員抑制了CAFs的增殖,破壞了CAFs對腫瘤細(xì)胞的保護(hù),進(jìn)而促進(jìn)光療過程中活性小分子對腫瘤細(xì)胞的熱消融和殺傷。
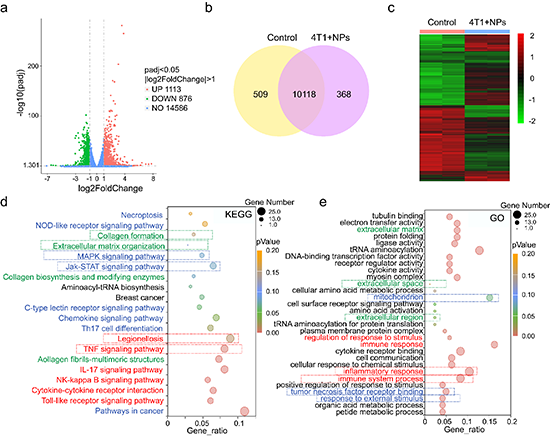
圖8. MCH-OBN + Laser治療后4T1腫瘤細(xì)胞轉(zhuǎn)錄分析

圖9. MCH-OBN + Laser 治療后CAF培養(yǎng)4T1腫瘤細(xì)胞的轉(zhuǎn)錄分析
總之,該工作首次關(guān)注了免疫狀態(tài)對光療抗腫瘤效果的決定性作用。MCH-OBN納米平臺對野生型和免疫缺陷小鼠的腫瘤療效差異證實(shí)了光療對免疫激活狀態(tài)的強(qiáng)烈依賴性,在此基礎(chǔ)上,研究者進(jìn)一步證實(shí)了光療中免疫系統(tǒng)通過破壞CAFs對腫瘤細(xì)胞的物理屏障促進(jìn)腫瘤細(xì)胞死亡的生物調(diào)控機(jī)制,對臨床開發(fā)以CAFs為靶點(diǎn)的免疫輔助光療抗腫瘤策略具有重要意義。
該工作以“Activated Immune System Determines In Vivo Anti-Tumor Effect of Phototherapy by Inhibiting Cancer-Associated Fibroblasts”為題發(fā)表在Advanced Functional Materials上。青島農(nóng)業(yè)大學(xué)孔曉穎副教授、康復(fù)大學(xué)師進(jìn)生教授/周祺惠研究員為論文的通訊作者,青島農(nóng)業(yè)大學(xué)碩士畢業(yè)生丁萌超以及在讀碩士陳昊宇為論文共同第一作者。該研究得到了國家自然科學(xué)基金、山東省自然科學(xué)基金、國家重點(diǎn)研發(fā)項(xiàng)目、山東省泰山青年學(xué)者資助項(xiàng)目等基金支持。
原文鏈接:https://doi.org/10.1002/adfm.202315551










