清華大學杜娟娟/軍事醫學研究院楊益隆合作團隊 ACS Nano:一種激活兩條天然免疫途徑的無佐劑納米疫苗
2024-03-19 來源:高分子科技
以往研究表明抗原與佐劑的協同遞送可以實現抗原遞呈與免疫激活的時空協調,但開發復雜的共遞送系統對于亞單位疫苗的生產與質控提出了新的挑戰。近期,清華大學藥學院杜娟娟團隊聯合軍事醫學研究院楊益隆副研究員,發現了一種能夠同時激活cGAS/STING和TLR9/MyD88兩條天然免疫通路的高分子聚合物p(AMPS-co-DMAEMA)。該聚合物與新冠病毒S蛋白RBD結構域或者猴痘病毒抗原M1R蛋白共價偶聯后,無需添加商業化佐劑即能在小鼠體內引起強效的體液免疫和細胞免疫應答。該工作以“A Polymer-Based Antigen Carrier Activates Two Innate Immune Pathways for Adjuvant-Free Subunit Vaccines”為題發表在《ACS Nano》上(DOI: 10.1021/acsnano.4c00925)。

針對慢性傳染病的亞單位疫苗在臨床試驗中表現出CD8+ T細胞免疫應答較弱的局限性。為了改善亞單位疫苗的保護效果,佐劑聯合的策略被廣泛應用于疫苗設計中,但這種復合佐劑的共遞送對于疫苗的工業化生產提出了更高的要求。近年來,一些抗原遞送載體,如高分子聚合物PC7A(Luo et al., 2017)、F-PEI(Xu et al., 2020)、PEI4BImi(Zhao et al., 2022)等,表現出激活天然免疫的特性,這說明聚合物可以同時發揮佐劑和遞送載體的雙重作用,從而簡化亞單位疫苗的組分。
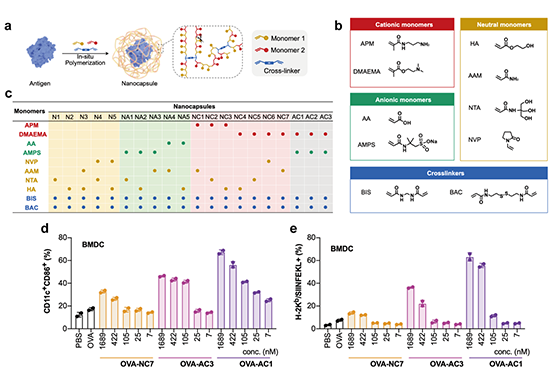
圖1. 體外篩選具有DC激活能力的聚合物單體組合 (Jia 2023)
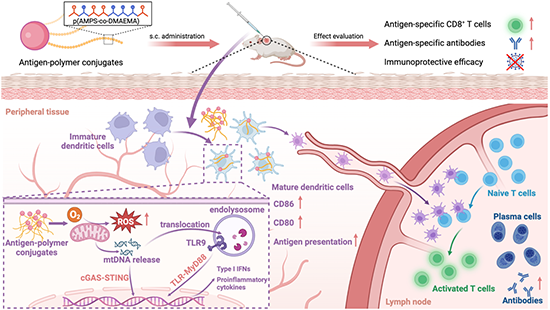
圖2. 抗原-聚合物偶聯物作為無佐劑納米疫苗遞送載體
原文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.4c00925
版權與免責聲明:中國聚合物網原創文章。刊物或媒體如需轉載,請聯系郵箱:info@polymer.cn,并請注明出處。
(責任編輯:xu)
相關新聞
- 中科大張世武/伯明翰大學唐詩楊/伍倫貢大學李衛華《Sci. Adv.》:可主動調節剛度/電導率的導電彈性體 2023-02-04
- 西南交大朱旻昊、樊小強等 Adv. Colloid Interfac.:Ti3C2Tx MXene增強聚合物用于磨蝕防護研究進展 2022-10-13
- 東華大學武培怡/焦玉聰團隊《Adv. Sci.》:凝膠電解質官能團助力鋅金屬(002)晶面成核 2022-01-20
- 東華大學沈明武/史向陽團隊 Bioact. Mater.:基于納米凝膠的治療型納米疫苗通過全周期免疫調節實現腫瘤的預防及直接治療 2024-09-25
- 上海交大劉盡堯團隊 Small:雙抗原展示納米疫苗 2023-12-08
- 天津大學王漢杰/劉培源 Biomaterials:工程菌在體可控生產釋放腫瘤納米疫苗 2023-05-18
- 中科大王育才/李敏團隊 Nat. Biomed. Eng.: 設計低免疫原性mRNA遞送載體在體內重編程耐受性APC 2025-04-01
