在眾多腫瘤免疫治療方式中,癌癥納米疫苗由于可以訓練免疫系統使其對腫瘤抗原敏感進而實現對腫瘤的抑制受到了廣泛關注。典型的癌癥納米疫苗總是由腫瘤相關抗原(tumor-associated antigens, TAAs, 用于賦予疫苗特異性)、佐劑(用于免疫激活)及納米載體(用于增強抗原及佐劑的遞送)共同組成。目前,大多數已開發的納米疫苗僅攜帶模型抗原,如卵清蛋白等,用于直接對抗單個抗原靶點。然而,考慮到腫瘤的持續進展和遺傳異質性,這種納米疫苗無法引起足夠的免疫響應。下一代納米疫苗制劑需要整合豐富的TAAs,以達到誘導充足的抗腫瘤免疫的閾值。攜帶了完整膜蛋白矩陣的癌細胞膜有望作為TAAs,用于觸發對相應腫瘤的特異性免疫反應。
為了增強癌細胞膜向免疫細胞的遞送,可以在癌細胞膜上修飾靶向配體,但這種工程化細胞膜的合成過程復雜且低效。考慮到原位腫瘤疫苗往往通過直接腫瘤治療,如化療、放療或光熱治療等誘導腫瘤細胞凋亡并釋放可激活免疫的TAAs,一種可能最大化癌細胞膜免疫調節性能的方法是在提取細胞膜前先誘導癌細胞凋亡。由于凋亡的癌細胞往往會伴隨著免疫原性死亡(ICD)的發生,使鈣網蛋白(CRT)等ICD標志物外翻至細胞表面,因此凋亡的癌細胞膜(apoptotic cancer cell membranes,AM)也有可能會攜帶CRT,這將使AM易于被免疫細胞識別攝取以更好地激活免疫。
除了攜帶的TAAs外,納米疫苗的腫瘤預防和治療效果還受到免疫抑制腫瘤微環境(TME)和腫瘤抑制效率不足的阻礙。因此,在激活免疫的同時具備直接殺傷腫瘤能力的多功能納米疫苗將有望獲得增強的腫瘤抑制性能。但如果在納米疫苗中加入傳統的細胞毒性抗腫瘤藥物,則可能會對免疫細胞產生不良副作用,抑制免疫細胞活性。利用外部能量或特殊信號僅在腫瘤部位觸發治療的局部療法因其非侵襲性、特異性和高效性而吸引了越來越多的關注。聲動力學療法(SDT)可通過超聲(US)局部激活聲敏劑,產生細胞毒性單線態氧(1O2)用于抑制腫瘤生長。此外,SDT能夠誘導癌細胞發生ICD,為將SDT用于增強免疫調節提供了可行性。此外,SDT過程中產生的1O2作為活性氧(ROS)的一種,會造成無法修復的DNA損傷并使損傷后的DNA從細胞核逃逸到胞質中,用于激活干擾素基因(STING)通路。
細胞中cGAS-STING通路的激活會促進I型干擾素(IFN)和促炎細胞因子的分泌,這些細胞因子可以熟化樹突細胞(DCs),并進一步活化T細胞以激活適應性免疫。除了上述的ROS及一些傳統的STING激活劑外,最近的研究表明Mn2+可以直接刺激cGAS、增強cGAS對胞質dsDNA的敏感性并提高cGAMP與STING的結合效率,從而促進STING的激活。
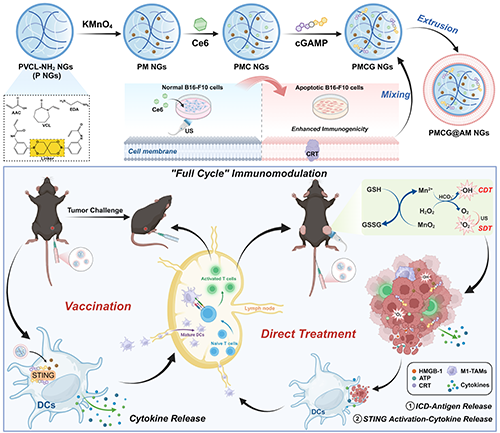
圖1. PMCG@AM NGs的合成及其在體內與US聯合進行全周期免疫調節示意圖。

圖2.(A)PMCG NGs的SEM圖;(B)PMC及PMCG NGs的UV-vis吸收光譜;(C)不同條件下PMCG NGs釋放Mn2+情況;(D)不同條件下MnO2的轉化;(E)不同NGs在H2O2溶液中產生O2情況;(F)PMCG NGs在不同GSH濃度下對MB的降解百分比;分散在(G)超純水中或(H)分散在模擬TME溶液中的PMCG NGs產生1O2情況及(I)產生速率。

圖3.(A)AM提取示意圖;經不同濃度Ce6處理的B16-F10細胞在US輻照前后細胞內(B-C)ROS水平及(D)凋亡率;(E)根據蛋白組學結果分析膜蛋白的變化;(F)PMCG@AM NGs的TEM圖像;PMCG@AM NGs產生(G)O2、(H)1O2及(I)·OH情況。

圖4.(A)B16-F10細胞、DCs或RAW細胞與不同NGs共孵育后細胞內Mn的吞噬量;不同NGs與(B)DCs及(C)RAW細胞共孵育24 h后的細胞活力圖;(D)NGs直接激活免疫細胞示意圖;經不同處理后(E-F)DCs或(G-H)RAW細胞釋放的IFN-β及TNF-α;(I)經不同處理后DCs熟化情況的流式分析圖。

圖5.(A)不同NGs在小鼠淋巴結中的積累;(B)體內疫苗免疫及腫瘤挑戰時間線;(C)經3次疫苗免疫后各組(C)淋巴結中DCs熟化、(D)脾臟中T細胞分型的流式分析圖及(E)血清中相關細胞因子的表達情況;(F)腫瘤挑戰實驗中各組小鼠腫瘤體積變化;(G-H)經不同治療后第21天小鼠脾臟中記憶T細胞的百分比。
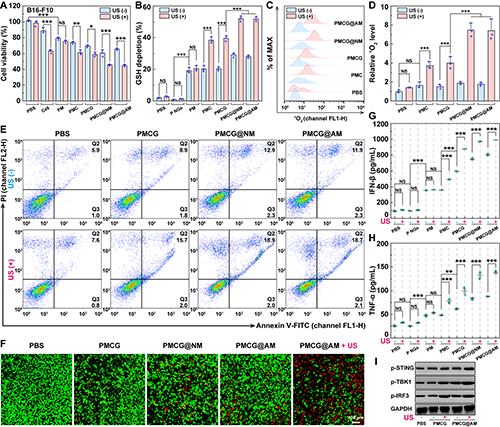
圖6.經不同處理后B16-F10 細胞的(A)細胞活力圖、(B)細胞內GSH 消耗百分比及(C-D)1O2表達水平;經不同處理后B16-F10 細胞(E)凋亡情況流式分析圖及(F)死活染色的CLSM圖;經不同處理后B16-F10 細胞釋放的(G)IFN-β 、(H)TNF-α及(I)細胞內STING通路相關蛋白的WB試驗結果圖。

圖7.(A)體內抗雙側腫瘤治療時間線;治療期間各組小鼠(B)原發瘤及(C)遠端瘤體積變化;經14天治療后各組(D-H)原發瘤及(J-N)遠端瘤中T細胞分型、細胞因子表達情況、TUNEL染色分析、CRT染色分析及腫瘤細胞凋亡率。
總的來說,該研究設計的NGs具有多個優勢:1)NGs的雙重響應性使其能夠在特定條件下選擇性解離,實現可控的藥物釋放;2)提取的AM既可維持癌細胞膜的靶向能力,還可增強膜蛋白的免疫原性使其更易被免疫細胞識別吞噬;3)Mn2+、cGAMP和AM的聯合使用可以通過激活STING通路熟化免疫細胞,并向T細胞呈遞TAAs以實現特異性腫瘤預防;4)US輻照的加入可在腫瘤部位觸發局部SDT,與Mn2+介導的CDT聯合作用誘導ICD,ICD誘導的免疫反應與NGs直接激活的免疫應答協同作用,完成全周期免疫調節,有效抑制雙側腫瘤的生長。
文章鏈接:https://www.sciencedirect.com/science/article/pii/S2452199X24004195
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 東華大學史向陽教授團隊:外泌體包裹的響應性樹狀大分子納米凝膠可實現急性肺損傷的免疫調節和抗氧化聯合治療 2025-05-15
- 東華大學史向陽/沈明武團隊 Acta Biomater.:仿生含銅納米凝膠用于磁共振成像引導的腫瘤化療-化學動力學治療-免疫治療 2024-10-03
- 清華大學杜娟娟/軍事醫學研究院楊益隆合作團隊 ACS Nano:一種激活兩條天然免疫途徑的無佐劑納米疫苗 2024-03-19
- 上海交大劉盡堯團隊 Small:雙抗原展示納米疫苗 2023-12-08
- 天津大學王漢杰/劉培源 Biomaterials:工程菌在體可控生產釋放腫瘤納米疫苗 2023-05-18
- 東南大學葛麗芹教授團隊 CEJ 綜述:具有免疫調節特性的工程化微膠囊在癌癥、炎癥和自身免疫中的應用 2025-04-09
