帕金森病(PD)是最常見(jiàn)的神經(jīng)退行性疾病之一,以多巴胺能神經(jīng)元進(jìn)行性損傷和黑質(zhì)(SN) α-突觸核蛋白(α-syn)異常積累為主要特征。過(guò)度激活的腦免疫微環(huán)境是PD快速進(jìn)展的關(guān)鍵因素,由腦內(nèi)常駐小膠質(zhì)細(xì)胞的神經(jīng)炎癥和腦外周免疫細(xì)胞的持續(xù)浸潤(rùn)共同推動(dòng)。為解決腦內(nèi)過(guò)度激活的小膠質(zhì)細(xì)胞中產(chǎn)生的神經(jīng)炎癥問(wèn)題,目前已經(jīng)提出了許多策略,包括激活下游的抗炎信號(hào)通路如NF-κB或利用納米酶的生物催化。然而,值得注意的是,如果不能及時(shí)預(yù)防神經(jīng)炎癥產(chǎn)生的源頭或腦外周免疫細(xì)胞浸潤(rùn)引起的免疫惡化,很難達(dá)到治療PD的目的。因此,需要綜合治療的方法以橋接腦內(nèi)部和外部以重塑PD過(guò)度激活的免疫微環(huán)境。

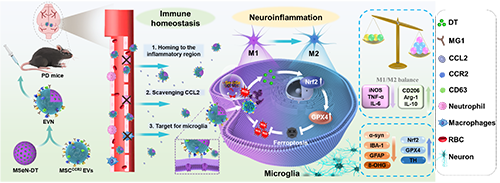
圖1. 過(guò)表達(dá)CCR2的工程細(xì)胞外囊泡納米制劑的制備及其對(duì)PD治療的調(diào)控示意圖
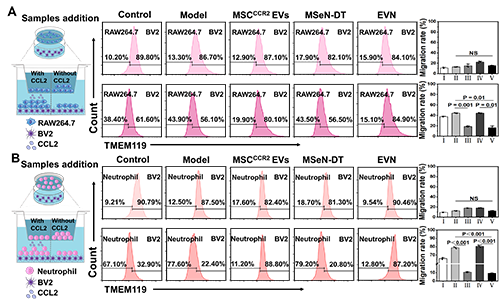
在Transwell實(shí)驗(yàn)中,將RAW264.7或中性粒細(xì)胞(主要外周免疫細(xì)胞)置于上腔,將不同條件下的小膠質(zhì)細(xì)胞系(BV2細(xì)胞)置于下腔進(jìn)行Transwell實(shí)驗(yàn)。結(jié)果顯示,與MSCCCR2 EVs和MSeN-DT組相比,EVN組RAW264.7細(xì)胞的遷移率明顯受到抑制,遷移率為16.47%(圖2A)。此外,中性粒細(xì)胞向下腔的遷移也呈現(xiàn)出類似的趨勢(shì),表明對(duì)浸潤(rùn)有抑制作用(圖2B)。
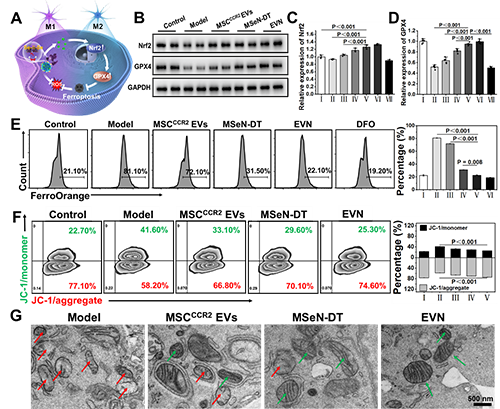
圖3. EVN調(diào)節(jié)小膠質(zhì)細(xì)胞表型變化的藥理學(xué)機(jī)制。(A) Nrf2-GPX4信號(hào)通路示意圖。(B)不同處理后BV2細(xì)胞Nrf2和GPX4表達(dá)的WB分析。(C, D)各組Nrf2和GPX4的相對(duì)表達(dá)量,其中對(duì)照組的表達(dá)量表示為1 (I:對(duì)照組,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, VI: tBHQ, VII: ML385, n = 5)。(E)流式細(xì)胞術(shù)檢測(cè)Fe2+熒光探針染色不同條件下BV2細(xì)胞內(nèi)Fe2含量的研究(I:對(duì)照組,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, VI:(F) JC-1流式細(xì)胞術(shù)檢測(cè)不同處理后BV2細(xì)胞線粒體膜電位(I:對(duì)照,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, n = 3)。(G)不同處理后BV2線粒體代表性生物透射電鏡圖像(紅箭頭:線粒體脊減少,綠箭頭:線粒體脊增加)
基于之前的說(shuō)法,他們假設(shè)所遞送的DT可以有效激活Nrf2,通過(guò)Nrf2?GPX4途徑消除上游ROS的產(chǎn)生,抑制鐵下沉(圖3A)。抑制鐵凋亡和阻斷上游ROS生成的一個(gè)重要方面是通過(guò)EVN傳遞的DT完全激活Nrf2表達(dá)。本研究以Nrf2激動(dòng)劑叔丁基對(duì)苯二酚(TBHQ)和Nrf2抑制劑ML385分別作為陽(yáng)性和陰性對(duì)照。如圖3B、C所示,EVN組通過(guò)抑制Keap1蛋白的表達(dá),有效促進(jìn)Nrf2的胞內(nèi)釋放。在PD患者的大腦中,細(xì)胞中GPX4的失活或減少導(dǎo)致脂質(zhì)活性氧的產(chǎn)生,從而誘導(dǎo)小膠質(zhì)細(xì)胞中的鐵死亡如圖3B、D所示,與對(duì)照組相比,MSeN-DT和EVN上調(diào)Nrf2和GPX4的表達(dá)。Fe2+水平升高是PD患者鐵代謝異常的直接原因。
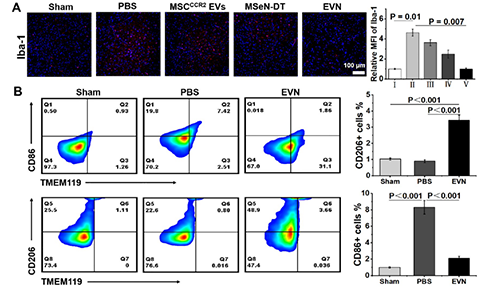
圖4. EVN在體內(nèi)抑制神經(jīng)炎癥的能力評(píng)估。(A)不同處理小鼠SN中Iba-1(紅色)的代表性免疫熒光圖像及相應(yīng)的定量分析,其中假手術(shù)組Iba-1的相對(duì)MFI為1 (n = 3)。(B)流式細(xì)胞術(shù)研究不同處理小鼠中腦小膠質(zhì)細(xì)胞表型及不同條件下小膠質(zhì)細(xì)胞CD86和CD206的相應(yīng)百分比(n = 3)。
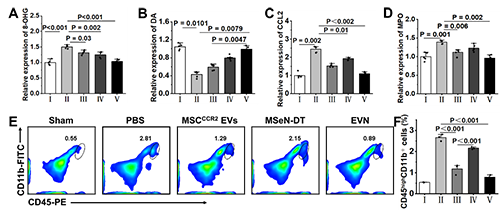
圖5. EVN阻止腦外周免疫細(xì)胞浸潤(rùn)的體內(nèi)治療機(jī)制(A?F)不同處理小鼠腦內(nèi)MPO、DA、8-OHG、CCL2的相對(duì)定量(其中假手術(shù)組的相對(duì)表達(dá)量記為1,n = 5)。(H)各組腦內(nèi)巨噬細(xì)胞(CD45high、CD11b+)的流式細(xì)胞術(shù)分析和(I)定量分析。
他們將8-羥基鳥(niǎo)苷(8-OHG)的表達(dá)水平作為氧化損傷的標(biāo)志物來(lái)評(píng)估EVN減輕PD腦氧化損傷的能力(圖5A)。與模型組相比,MSCCCR2 EVs、MSeN-DT和EVN治療組8-OHG表達(dá)水平顯著降低,達(dá)到與假手術(shù)組相似的水平。這說(shuō)明EVN具有較強(qiáng)的活性氧清除能力。多巴胺(DA)濃度是臨床評(píng)價(jià)PD治療效果的標(biāo)準(zhǔn),如圖5B所示,他們還對(duì)這些小鼠紋狀體中DA的濃度進(jìn)行了評(píng)估,以進(jìn)一步證明EVN的治療作用。與PBS組比較,MSCCCR2 EVs、MSeN-DT和EVN均使小鼠DA濃度升高。特別是,EVN處理小鼠的DA濃度恢復(fù)到與假手術(shù)組相似的水平。綜上所述,EVN通過(guò)激活Nrf2?GPX4通路,有效抑制腦內(nèi)小膠質(zhì)細(xì)胞的神經(jīng)炎癥。進(jìn)一步研究了EVN在體內(nèi)抑制外周細(xì)胞浸潤(rùn)的能力。
原文鏈接:
Engineered Extracellular Vesicle-Based Nanoformulations That Coordinate Neuroinflammation and Immune Homeostasis, Enhancing Parkinson''''s Disease Therapy. ACS Nano. 2024 Aug 15. doi: 10.1021/acsnano.4c04674.
https://doi.org/10.1021/acsnano.4c04674
- 空軍軍醫(yī)大學(xué)金巖團(tuán)隊(duì)《Sci.Adv.》:工程化細(xì)胞外囊泡在調(diào)節(jié)炎癥和促進(jìn)組織再生方面取得新進(jìn)展 2020-07-23
- 天工大高輝/余云健團(tuán)隊(duì) JCR:腫瘤和瘤內(nèi)病原體級(jí)聯(lián)靶向光熱納米制劑用于增強(qiáng)結(jié)直腸癌免疫治療 2025-01-27
- 法國(guó)艾克斯-馬賽大學(xué)彭玲/中國(guó)藥大劉瀟璇/港大黃思齊 ACS AMI:兩親性樹(shù)形分子包裹的伊馬替尼針對(duì)轉(zhuǎn)移性卵巢癌的有效治療策略 2025-01-06
- 安中醫(yī)陳勝麒/胡容峰課題組《J. Control. Release》:新藤黃酸納米制劑實(shí)現(xiàn)肝癌的自增強(qiáng)抗血管治療 2023-05-09
- 西南交大魯雄/中國(guó)海大韓璐/北京基礎(chǔ)醫(yī)學(xué)研究所江小霞等Nano Today:導(dǎo)電粘附水凝膠調(diào)控創(chuàng)傷性腦損傷后的神經(jīng)炎癥與神經(jīng)功能 2023-07-23
