急性肺損傷(ALI)通常以呼吸窘迫、低氧血癥和炎癥的快速發(fā)作為特征,常由創(chuàng)傷、感染或全身性疾病引發(fā)。傳統(tǒng)治療方法主要依賴支持性護理如機械通氣和氧療,但這些方法存在局限性且無法精準作用于損傷部位。盡管藥物治療仍是ALI治療的核心手段,但其臨床應用常因副作用而受限。多酚類化合物因其抗氧化和抗炎特性備受關(guān)注,但其臨床應用面臨重大挑戰(zhàn),主要源于生物利用度低諸如口服吸收差、在胃腸道和肝臟中代謝迅速,導致體內(nèi)有效濃度降低。此外,環(huán)境因素(如pH值、溫度和酶解作用)易破壞多酚的穩(wěn)定性,進一步削弱其療效。高劑量多酚還可能引發(fā)肝毒性、腎毒性或與其他藥物產(chǎn)生不良反應。因此,設(shè)計合適的靶向載體以改善多酚類藥物的生物利用度與穩(wěn)定性,對最大化其在ALI治療中的潛力至關(guān)重要。
為突破上述限制,微納米載藥系統(tǒng)的開發(fā)成為研究焦點。傳統(tǒng)微球制備技術(shù)(如溶劑揮發(fā)法、乳液聚合法)存在工藝缺陷如溶劑殘留、粒徑不均、載藥效率低及突釋效應明顯。相比之下,電噴霧技術(shù)憑借精準電場調(diào)控可制備粒徑均一、結(jié)構(gòu)可控的載藥微球,其低溫加工特性尤其適用于熱敏感藥物。基于同軸電噴技術(shù)構(gòu)建的核殼微球,不僅能通過孔隙率調(diào)控實現(xiàn)長達數(shù)周的緩釋,還可利用表面功能化修飾(如纖連蛋白涂層)賦予病灶靶向能力,顯著提升肺部藥物蓄積效率。
近年來,針對ALI中巨噬細胞極化失衡的關(guān)鍵機制,研究揭示生物活性蛋白(如纖連蛋白FN)可通過整合素信號通路驅(qū)動M2型抗炎表型轉(zhuǎn)化,與多酚類藥物的抗氧化作用形成互補。這一發(fā)現(xiàn)為設(shè)計多功能納米載體提供了重要啟示:通過空間分隔負載不同活性成分(即核殼結(jié)構(gòu)),這種載藥方式既可避免分子間相互作用導致的失活,又能實現(xiàn)病灶部位的程序化釋放。此外,有效調(diào)控以TNF-α、IL-1β、IL-6等促炎細胞因子過度分泌為特征的"細胞因子風暴",是炎癥性疾病治療的關(guān)鍵環(huán)節(jié)。這些細胞因子的過量產(chǎn)生會加劇炎癥級聯(lián)反應,可能導致多器官損傷或死亡。

圖1、RPG@FN微球的制備及其在ALI中的治療機制示意圖。

圖2、(A)以芘為熒光探針測定的PCL-PEG膠束臨界膠束濃度(CMC)。(B)游離Res、PCL-PEG/Res、RPG、RPG@BSA及RPG@FN的流體力學尺寸和(C)Zeta電位。(D)RPG@FN的掃描電鏡(SEM)圖像及(E)粒徑分布直方圖。(F)FN、RPG@FN、BSA、RPG@BSA和RPG的SDS-PAGE蛋白分析。(G)RPG@FN分散于水、PBS或含10%胎牛血清(FBS)的RPMI-1640培養(yǎng)基中不同時間段的流體力學尺寸變化。(H)RPG、RPG@BSA及RPG@FN在PBS中的Res累積釋放曲線。(I)RPG、RPG@BSA和RPG@FN于37 °C PBS中持續(xù)8周的體外降解曲線。圖(B)、(C)及(G-I)中實驗重復3次(n=3),"ns"表示無統(tǒng)計學差異。

圖3 (A)不同濃度Res、PCL-PEG/Res及RPG@FN處理MH-S細胞24小時的活力(n = 6)。(B)PBS、FN或RPG@FN處理MH-S細胞12小時后的熒光強度及(C)定量分析(n = 3)。(D)RGD預封閉處理對RPG@FN靶向MH-S細胞的熒光強度影響定量分析(n = 3);C-D圖中FN經(jīng)Cy5.5標記。(E)不同材料處理12小時后,DCFH-DA探針檢測MH-S細胞活性氧(ROS)的熒光強度及(F)定量分析(n = 3)。(G)LPS激活的MH-S細胞與Res、FN、RPG@BSA或RPG@FN共孵育6小時,DCFH-DA染色后的共聚焦激光掃描顯微鏡(CLSM)圖像(標尺:40 μm)。(H)JC-1熒光探針檢測不同材料處理下MH-S細胞線粒體膜電位(MMP)的流式細胞術(shù)分析。C-D及F圖中***表示p < 0.001。

圖4、(A)不同處理組MH-S細胞CD86與CD206表達水平的流式細胞術(shù)分析。(B)CD206陽性與(C)CD86陽性巨噬細胞比例統(tǒng)計。(D)TNF-α、(E)IL-6、(F)IL-1β及(G)IL-10在細胞內(nèi)的表達水平(24小時處理)。(H)細胞培養(yǎng)液中一氧化氮(NO)濃度檢測。(I)蛋白質(zhì)印跡(WB)分析不同處理組MH-S細胞中NF-κB與磷酸化Akt(p-Akt)的表達水平(I組:PBS;II組:LPS;III組:Res;IV組:FN;V組:RPG@BSA;VI組:RPG@FN)。圖(B-H)中實驗重復3次(n = 3),*表示p < 0.05,***表示p < 0.001。
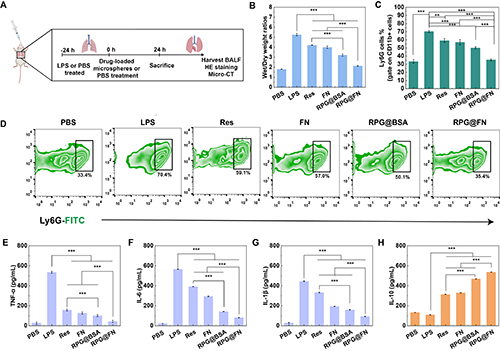
圖5、(A)ALI小鼠體內(nèi)抗炎治療示意圖。(B)不同處理組ALI小鼠肺組織濕干重比。(C)各組小鼠肺組織中性粒細胞比例。(D)不同處理24小時后肺組織中性粒細胞流式細胞術(shù)點圖。(E-H)支氣管肺泡灌洗液(BALF)中促炎因子(TNF-α、IL-6、IL-1β)與抗炎因子(IL-10)水平檢測。圖(B-C)及(E-H)中實驗重復3次(n = 3),**表示p < 0.01,***表示p < 0.001。
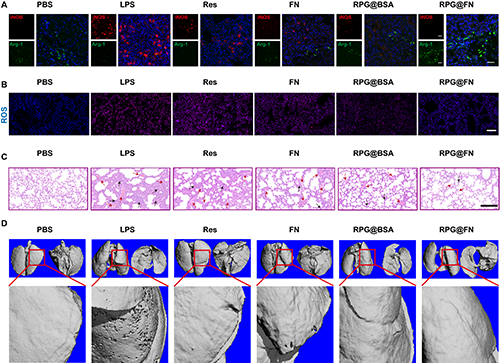
圖6、(A)通過免疫熒光染色評估不同處理組ALI小鼠肺組織巨噬細胞極化狀態(tài)(藍色:DAPI核染色;綠色:M2型標記物Arg-1;紅色:M1型標記物iNOS)。(B)各組ALI小鼠肺組織活性氧(ROS)清除效果(標尺:100 μm)。(C)肺組織H&E染色切片及(D)Micro-CT成像結(jié)果。圖C中紅色與黑色箭頭分別指示肺泡壁充血及炎癥細胞浸潤區(qū)域(標尺:200 μm)。
簡而言之,本研究采用同軸電噴技術(shù)開發(fā)了一種核殼結(jié)構(gòu)微球遞藥系統(tǒng)(RPG@FN),用于ALI的高效治療。該系統(tǒng)內(nèi)核由負載Res的PCL-PEG膠束構(gòu)成,外殼為PLGA材料,微球表面經(jīng)FN物理修飾。通過系統(tǒng)表征RPG@FN的粒徑形貌、穩(wěn)定性、藥物釋放及降解性能,證實其結(jié)構(gòu)完整性。體外實驗驗證了該體系在清除ROS、促進M2型巨噬細胞極化、恢復線粒體膜電位及調(diào)控炎癥因子等方面的抗炎抗氧化活性。進一步通過ALI小鼠模型體內(nèi)實驗評估其治療效果。RPG@FN微球的優(yōu)勢主要源于以下三點:(1)基于電噴技術(shù)構(gòu)建的核殼微球以載藥膠束為內(nèi)核,可實現(xiàn)肺部長效緩釋;(2)顯著提升Res與FN的生物利用度,避免其降解失活;(3)FN修飾賦予微球炎癥巨噬細胞靶向性,通過ROS清除與M2極化雙重機制,協(xié)同恢復線粒體穩(wěn)態(tài)并阻斷NF-κB/PI3K-Akt信號通路。
文章鏈接:https://doi.org/10.1016/j.jcis.2025.01.249
- 我國發(fā)明黏稠物快速檢測新方法 2009-11-10
- 蛋白質(zhì)非共價復合物的電噴霧質(zhì)譜(ESI-MS)研究 2004-06-02
- 東華大學沈明武研究員/史向陽教授團隊:銅摻雜層狀雙金屬氫氧化物共遞送蛋白/藥物調(diào)控腫瘤雙重代謝實現(xiàn)級聯(lián)的化學動力學/免疫治療 2025-02-08
- 東華大學沈明武/史向陽Biomaterials:具有生物活性的含磷樹狀大分子共遞送蛋白質(zhì)/藥物用于巨噬細胞重編程增強骨關(guān)節(jié)炎治療 2024-12-09
- 東華大學曹雪雁/史向陽團隊 AHM:仿生聚吡咯殼聚糖納米凝膠共遞送藥物和基因?qū)崿F(xiàn)轉(zhuǎn)移性前列腺癌的高效治療 2024-04-30
- 東華大學史向陽教授團隊 BAM:具有自身生物活性的羥基化含磷樹狀大分子腦內(nèi)遞送纖連蛋白協(xié)同調(diào)節(jié)小膠質(zhì)細胞實現(xiàn)帕金森病的增強治療 2024-04-26
- 東華大學史向陽教授團隊《ACS Nano》:纖連蛋白包覆的含磷樹狀大分子納米顆粒通過多重調(diào)節(jié)骨微環(huán)境增強骨關(guān)節(jié)炎治療 2024-04-05
