代謝重編程是癌癥的重要特征之一。腫瘤細胞的特定代謝途徑及其在腫瘤微環(huán)境(TME)中積累的代謝產(chǎn)物大大限制了效應T細胞對腫瘤細胞的免疫監(jiān)視和殺傷能力。靶向TME改變腫瘤代謝途徑被認為是下一代癌癥治療的理想策略。研究表明,TME中乳酸的積累不僅促進了腫瘤的生長、侵襲和轉(zhuǎn)移,還削弱了效應T細胞和自然殺傷細胞的功能,并促進了巨噬細胞的M2型免疫抑制表型轉(zhuǎn)化,從而建立了免疫抑制微環(huán)境。令人鼓舞的是,已被開發(fā)的調(diào)節(jié)乳酸代謝策略,能夠逆轉(zhuǎn)免疫抑制微環(huán)境,激活免疫系統(tǒng)。
納米遞送系統(tǒng)為改善蛋白質(zhì)和小分子藥物的遞送效率提供了一種新的策略,在改變腫瘤和免疫細胞的代謝途徑方面展示出良好的應用潛力。研究顯示,通過納米載體遞送乳酸氧化酶(LOX)或乳酸外排抑制劑來調(diào)節(jié)乳酸代謝,并結合聲動力治療、光熱治療或化療等策略顯示出良好的抗腫瘤效果。相關研究顯示乳酸作為關鍵代謝靶點,為激活免疫治療提供了一種新的可行策略。然而,當前的乳酸代謝治療策略主要集中在減少乳酸含量,設計能夠同時耗竭TME中乳酸并利用其降解產(chǎn)物過氧化氫(H2O2)增強腫瘤治療的納米藥物可大大提高腫瘤治療效果。此外,由于腫瘤細胞的代謝具有高度的可塑性,將乳酸代謝調(diào)節(jié)與其他代謝途徑結合起來靶向多條代謝途徑有望實現(xiàn)更高效的代謝調(diào)控治療。
腫瘤細胞的氧化還原代謝被認為是腫瘤治療的一個有效靶點。基于金屬離子介導的芬頓或類芬頓反應的化學動力學治療(CDT)是調(diào)節(jié)腫瘤氧化還原代謝平衡實現(xiàn)腫瘤治療的典型代表。其原理是通過將H2O2轉(zhuǎn)化為更具毒性的羥基自由基(?OH),從而誘導腫瘤細胞凋亡。盡管CDT具有良好的應用潛力,但是腫瘤內(nèi)低濃度的H2O2限制了?OH的持續(xù)產(chǎn)生。另外,細胞內(nèi)高水平的還原性物質(zhì)谷胱甘肽(GSH)則會捕捉生成的?OH,限制了CDT的治療效果。因此,構建能夠提高H2O2含量并降低GSH水平的納米藥物是提高CDT效率的關鍵。層狀雙金屬氫氧化物(LDH)是一種典型的二維無機納米材料,具有合成簡便、易于摻雜二價和三價金屬離子、對pH敏感和良好的生物相容性等特點,在腫瘤的診斷及治療領域顯示出良好的轉(zhuǎn)化潛力。

圖1、LDH-DC-LOX納米顆粒的制備及其用于調(diào)節(jié)乳酸和氧化還原代謝誘導級聯(lián)的化學動力學/免疫療法。

圖2、(A)LDH和(B)LDH-DC納米顆粒的透射電子顯微鏡(TEM)圖像(標尺:100 μm)。(C)LDH-DC、LOX、LDH-DC-LOX、BSA、LDH-DC-BSA的SDS-PAGE蛋白分析。LDH、DC、LDH-DC、LOX、LDH-DC-LOX的(D)紫外光譜和(E)紅外光譜。(F)LDH-DC-LOX在不同分散劑中的水合粒徑變化。(G)LDH-DC-LOX的乳酸降解能力。(H)LDH-DC-LOX在不同溶液中的電子自旋共振(ESR)圖譜。(I)LDH-DC-LOX與亞甲基藍(MB)溶液反應后的紫外吸收光譜。

圖3、(A)不同濃度LDH、LDH-DC-BSA、LDH-LOX或LDH-DC-LOX處理4T1細胞24小時的細胞活力(n = 6)。4T1細胞經(jīng)不同處理12 h(B)細胞內(nèi)和(C)細胞外的乳酸含量(n = 3)。4T1細胞經(jīng)不同處理6 h細胞內(nèi)的(D)GSH含量及(E和F)ROS含量(n = 3)。(G)LDH-DC-LOX改變腫瘤細胞內(nèi)氧化還原平衡增加ROS含量示意圖。圖(A-D,F(xiàn))中,*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
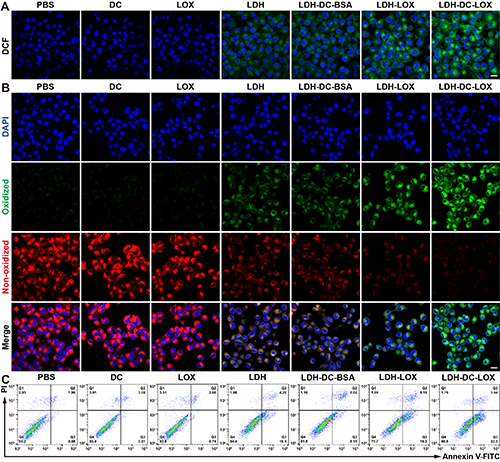
圖4、4T1細胞經(jīng)不同處理6 h的(A)ROS含量檢測及(B)脂質(zhì)過氧化物(LPO)含量檢測的激光共聚焦圖片(標尺:20 μm)。(C)4T1細胞經(jīng)不同處理24 h凋亡檢測的流式細胞術點圖(n = 3)。

圖5、(A)小鼠4T1腫瘤建立和抗腫瘤實驗評價流程示意圖。(B)荷瘤小鼠經(jīng)不同治療后的(B)相對體重變化(n = 5)、(C)相對腫瘤體積變化(n = 5)、(D)腫瘤體積變化(n = 5)。(E)各實驗組小鼠腫瘤切片的H&E及TUNEL染色圖片(標尺:50 μm)。(F)各實驗組小鼠肺組織切片的H&E染色圖片(標尺:1 mm)。圖(C-D)中,*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
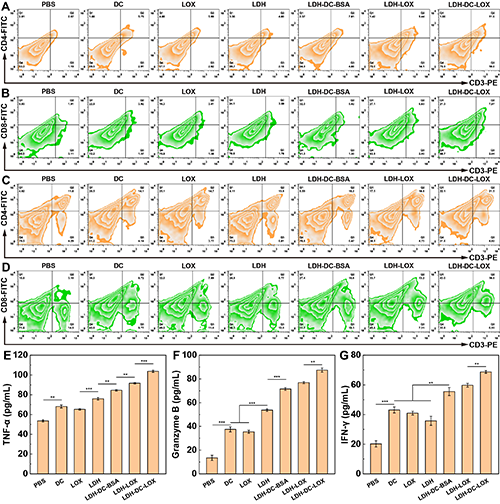
圖6、不同實驗組小鼠腫瘤中(A)CD 4+ T細胞和(B)CD 8+ T細胞的流式細胞術點圖。不同實驗組小鼠脾臟中(C)CD 4+ T細胞和(D)CD 8+ T細胞的流式細胞術點圖。各實驗組小鼠血清中(E)TNF-α、(F)Granzyme-B 和(F)IFN-γ的ELISA檢測結果(n = 3)。圖(E-G)中, **表示p < 0.01,***表示p < 0.001。

圖7、不同實驗組小鼠腫瘤中(A) IRF1、(B)SLC7A11、(C)GPX4蛋白表達水平的定量結果圖。(D)不同實驗組小鼠腫瘤腫GSH含量。不同實驗組小鼠腫瘤的(E和F)ROS和(E和G)LPO熒光圖像及其定量分析。
綜上所述,本研究設計的LDH-DC-LOX納米藥物具有以下顯著特點:(1)Cu2+、DC、LOX可在酸性TME條件下從納米平臺中釋放;(2)DC和LOX的聯(lián)合作用可有效調(diào)節(jié)乳酸代謝,減少TME中的乳酸,從而激活免疫治療,并生成H2O2;(3)摻雜的Cu2+能夠有效調(diào)節(jié)腫瘤細胞的氧化還原代謝,通過類芬頓反應將H2O2轉(zhuǎn)化為更具毒性的?OH,且通過消耗細胞內(nèi)的GSH增強CDT;(4)LOX催化乳酸產(chǎn)生的H2O2和由免疫應答激活后分泌的細胞因子IFN-γ可進一步增強CDT效果。因此,本研究所設計的LDH-DC-LOX納米藥物能夠有效地調(diào)節(jié)乳酸和氧化還原雙重代謝途徑,通過級聯(lián)作用激活免疫治療并增強CDT,為靶向代謝調(diào)控治療腫瘤提供了新的策略。
文章鏈接:https://doi.org/10.1016/j.actbio.2025.02.008
- 東華大學史向陽教授團隊 JCIS:電噴霧制備核殼微球共遞送纖連蛋白與白藜蘆醇協(xié)同治療急性肺損傷 2025-02-04
- 東華大學沈明武/史向陽Biomaterials:具有生物活性的含磷樹狀大分子共遞送蛋白質(zhì)/藥物用于巨噬細胞重編程增強骨關節(jié)炎治療 2024-12-09
- 東華大學曹雪雁/史向陽團隊 AHM:仿生聚吡咯殼聚糖納米凝膠共遞送藥物和基因?qū)崿F(xiàn)轉(zhuǎn)移性前列腺癌的高效治療 2024-04-30
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現(xiàn)精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調(diào)控熊果酸螺旋納米纖維原位動態(tài)組裝實現(xiàn)協(xié)同腫瘤增效治療 2025-05-13
- 東華大學郭睿教授/史向陽教授課題組 Acta Biomater.:仿生納米平臺介導的缺氧-腺苷軸破壞和PD-L1敲除用于增強MRI引導的化學動力學/免疫治療 2025-06-27
