近年來,科學界逐漸認識到細胞外基質(ECM)本質上具有粘彈性而非純彈性特性。然而,粘彈性與細胞之間的復雜相互作用機制尚未得到充分闡明。其中,粘彈性的時空調控與癌癥進展密切相關,但目前用于模擬ECM時空粘彈性的材料體系仍主要依賴于光引發劑和紫外光技術。這些現有體系普遍存在時空調控尺度有限、生物相容性差等局限性,難以實現長時間的粘彈性時空動態調控。因此,如何精確調控粘彈性力學的時空尺度,構建具有長波長、高生物安全性的仿ECM粘彈性模型,已成為細胞力學研究領域亟待突破的重大科學挑戰之一。
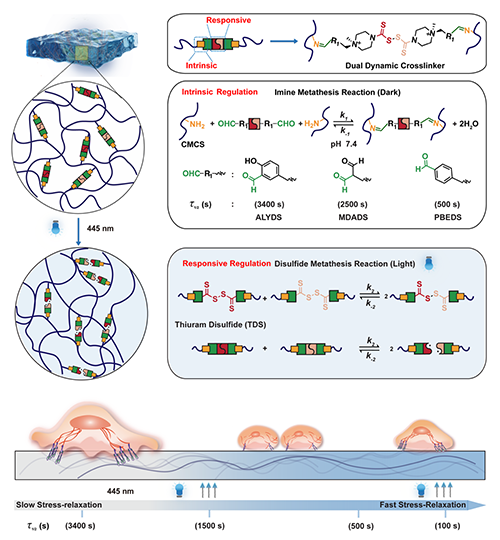
圖1 具有可見光響應動態粘彈性水凝膠的設計和制備
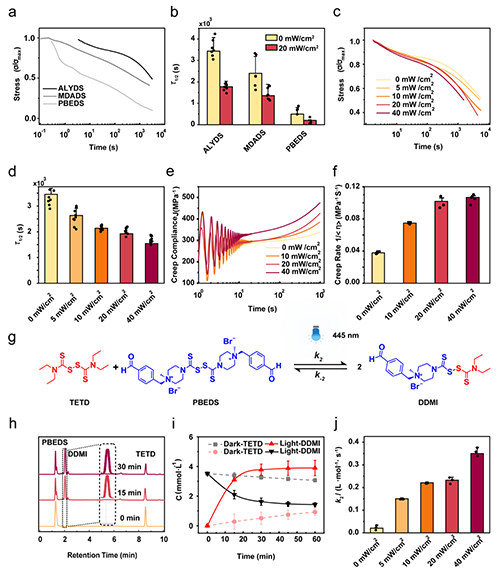
圖2 響應性粘彈性通過光強可以自由切換到不同的時空范圍

圖3 水凝膠的高時空分辨光圖案的制備和微小尺度粘彈性表征
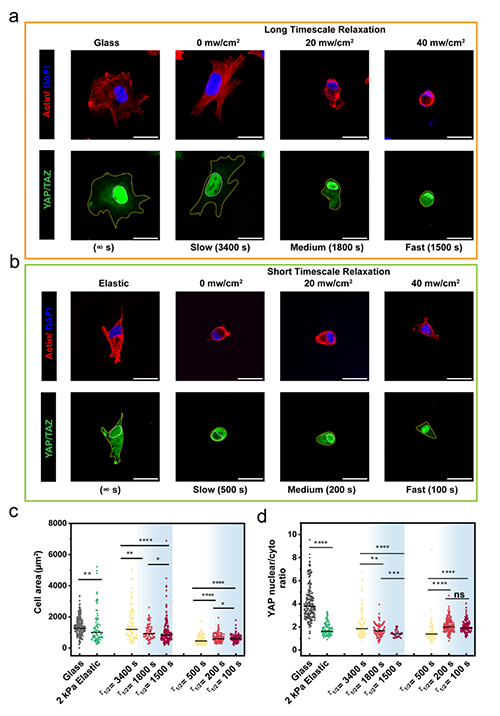
圖4 不同時空尺度下癌細胞的鋪展行為完全相反
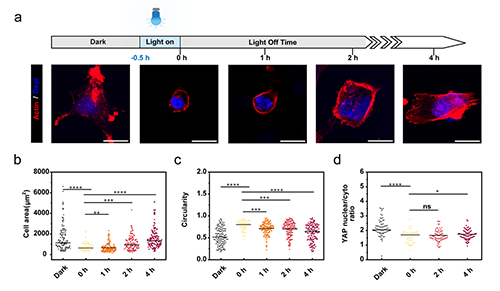
圖5 細胞可逆鋪展行為的切換
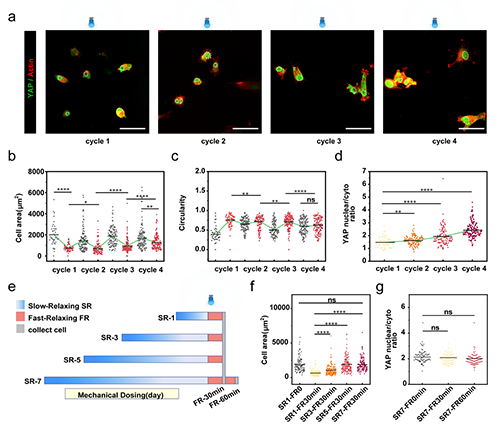
圖6 可循環的粘彈性調控細胞抵抗外界力學環境變化的能力
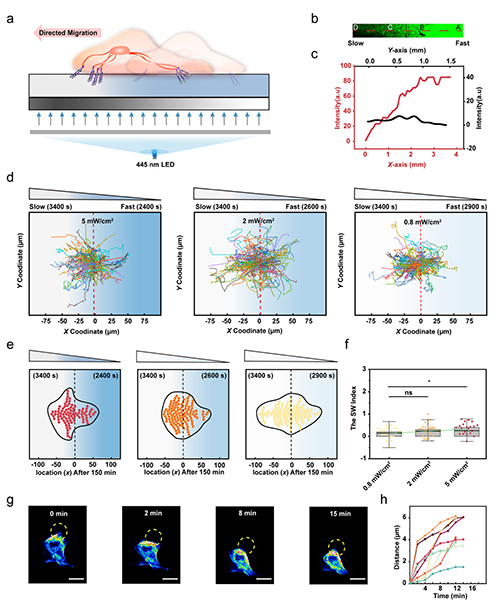
圖7 空間尺度上的粘彈性梯度調控細胞遷移的方向
5.通過光梯度掩膜版實驗,觀察到癌細胞在光致粘彈性梯度作用下表現出明顯的定向遷移行為,即從快松弛區域向慢松弛區域遷移。這種遷移行為源于細胞對不同粘彈性環境所產生的牽引力差異和肌球蛋白水平變化的響應。研究結果表明,粘彈性的時空差異性會顯著影響癌細胞的遷移能力。這一發現提示,在探索癌癥轉移的治療策略和藥物靶點時,除了考慮分子層面的因素外,還需要將組織的粘彈性尺度及其空間異質性納入研究范疇。這一認識為癌癥轉移機制的研究提供了新的視角,也為開發針對性的治療策略提供了重要參考。
論文標題:Visible Light-Responsive Hydrogels for Cellular Dynamics and Spatiotemporal Viscoelastic Regulation
論文鏈接:https://www.nature.com/articles/s41467-024-54880-0
- 湖南科大陳建教授等《Adv. Funct. Mater.》:可見光響應的光開關熒光聚合物用于光擦寫圖案、防偽和信息加密 2023-07-10
- 蘇州大學朱健教授/潘向強研究員課題組《Macromolecules》:基于烯丙基硒醚動態共價鍵的可見光響應液晶彈性體 2023-07-10
- 清華大學許華平教授課題組《Adv. Mater.》:二硒動態共價交換反應助力實現可調結構色圖案 2020-02-07
- 港中大(深圳)趙征 / 唐本忠團隊 ACS Nano :多功能AIE納米馬達突破腫瘤屏障 - 實現精準光診療 2025-05-29
- 山東大學欒玉霞教授團隊 Nat. Nanotech.:發現解決CAR-T細胞療法實體瘤療效受限的有效方法 2025-05-20
- 吉大陳學思院士、孫靜教授團隊 JACS:聚類肽輔助因子精準調控熊果酸螺旋納米纖維原位動態組裝實現協同腫瘤增效治療 2025-05-13
- 華南理工大學邊黎明教授團隊Nature Chemistry:可模擬細胞外基質液液相分離介導的組裝及生物物理特征的簡約模型 2025-06-10
