最近,國際權威期刊Nano Letters(影響因子12.08)在線報道了中國藥科大學孫敏捷教授和錢程根副研究員在抗腫瘤研究取得的最新進展——Biomimetic hybrid nanozymes with self-supplied H+ and accelerated O2 generation for enhanced starvation and photodynamic therapy against hypoxic tumors。中國藥科大學博士生楊學為論文第一作者,孫敏捷教授和錢程根副研究員為本文共同通訊作者。
自2007年Fe3O4納米顆粒被報道具有過氧化物酶活性以來,納米酶作為一種模擬天然酶活性的人工酶,和天然酶一起在癌癥的診斷和治療中得到了廣泛的關注。然而,如何保證酶在活體復雜的腫瘤微環境下還具有較強的酶活性仍是一個挑戰。例如:葡萄糖氧化酶(glucose oxidase, GOx)是一種天然的需氧酶,可以將葡萄糖氧化成葡萄糖酸和過氧化氫來干擾葡萄糖代謝,從而實現腫瘤饑餓治療。然而在腫瘤缺氧區域GOx酶活性隨著氧氣水平的降低而減弱。二氧化錳(manganese dioxide,MnO2)是一種具有過氧化氫酶活性的納米酶,它與腫瘤內源性過氧化氫反應生成氧氣,以減輕腫瘤乏氧。在酸性條件下,MnO2的催化效率可以大大提高。
針對上述問題,中國藥科大學孫敏捷教授課題組采用納米酶和天然酶相互促進的策略設計了一種高酶活性的新型仿生雜化納米酶(rMGB)用于乏氧腫瘤治療。在這項研究中,通過整合納米酶MnO2和天然酶GOx的特性,在腫瘤乏氧環境下,rMGB仿生納米酶系統中的MnO2可以與內源性H2O2反應生成O2,從而提高GOx的酶活性用于加速腫瘤饑餓治療的葡萄糖消耗;同時GOx通過氧化葡萄糖生成葡萄糖酸,提供大量的氫離子可以最大限度地提高MnO2的催化效率,進一步加速局部O2的生成,在腫瘤光動力治療中減輕腫瘤乏氧,加速具有腫瘤殺傷性的活性氧物質的生成。因此,rMGB利用納米酶和天然酶的相互促進,實現自供H+和加速O2生成,減輕腫瘤乏氧,提高抗腫瘤效率(圖1和2)。
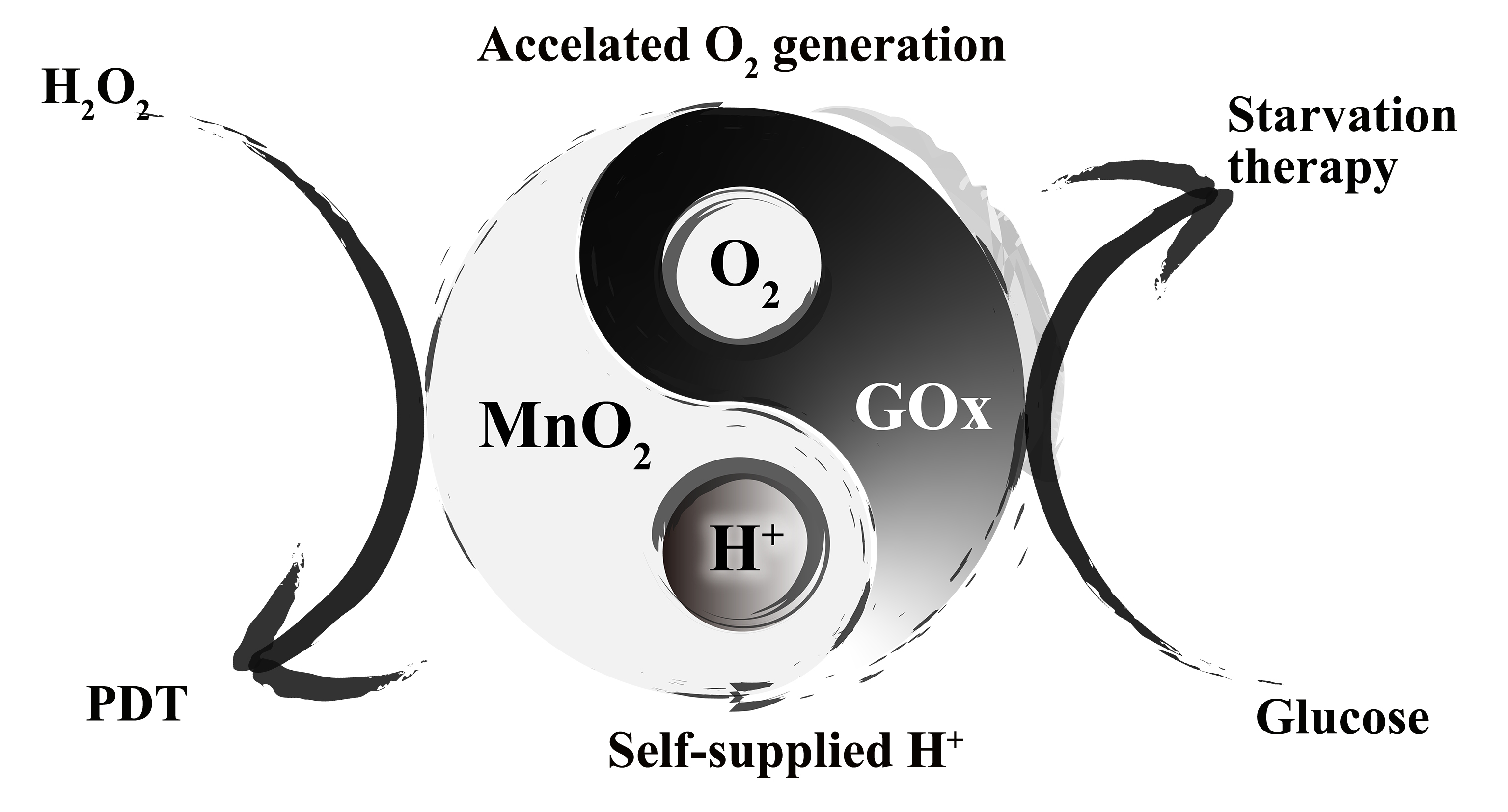
圖1. 仿生雜化納米酶rMGB中納米酶MnO2和天然酶GOx相互促進示意圖
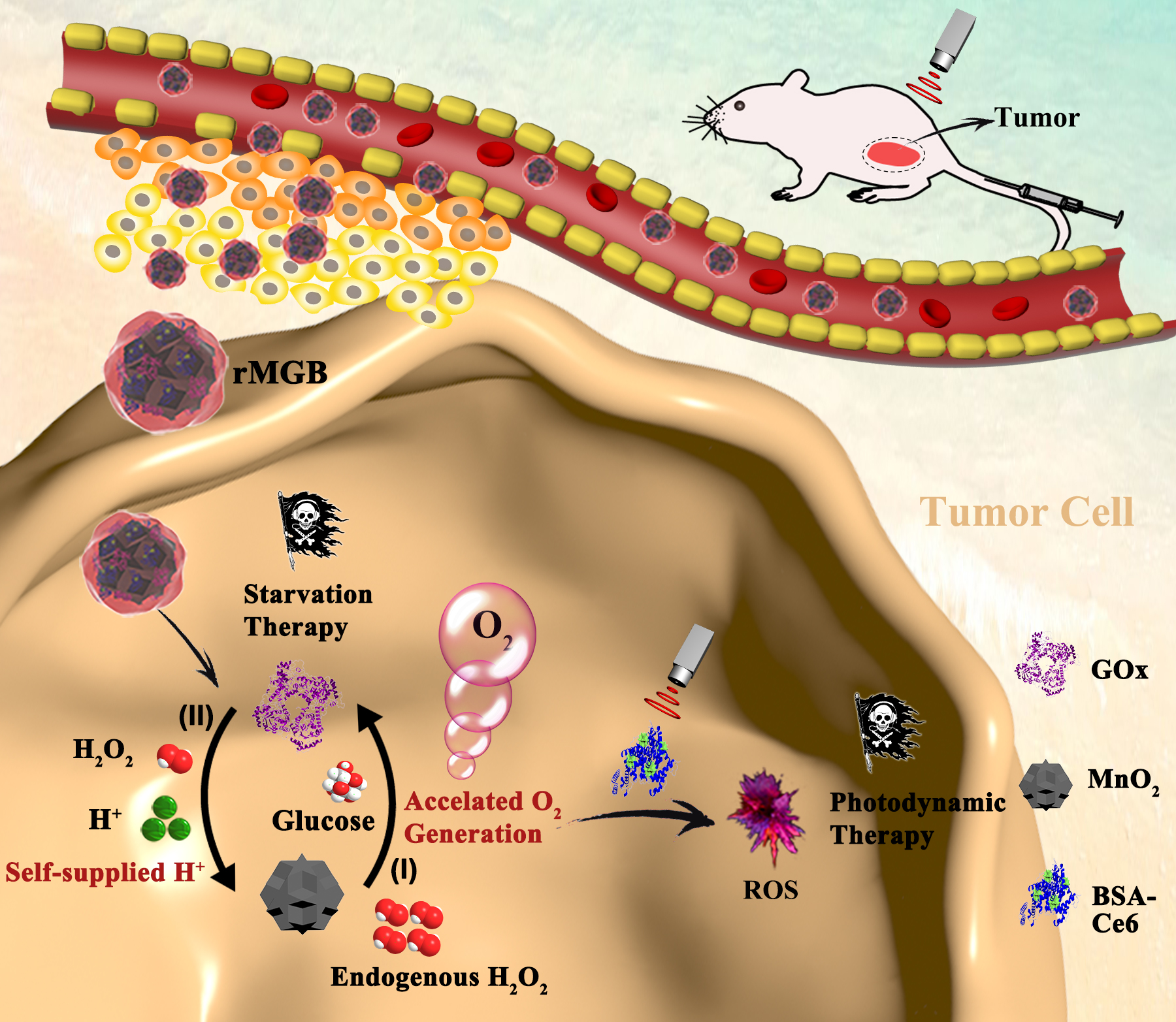
圖2. 新型仿生雜化納米酶通過自供H+和加速O2生成實現乏氧腫瘤光動力治療和饑餓治療
研究結果表明,設計的仿生雜化納米酶rMGB在常氧和乏氧條件下均能產生連續的O2。尤其對乏氧腫瘤具有較強的饑餓治療和PDT協同治療作用,在體內外均有較強的抗腫瘤作用。此外,由于rMGB外包覆的紅細胞膜的長循環能力和優異的生物安全性,rMGB是一種安全的藥物傳遞系統,小鼠安全性實驗初步證明不會引起系統性的影響。這種仿生雜化納米酶有望成為低氧腫瘤治療的潛在供氧劑。同時,該雜化納米酶為開發用于癌癥治療的催化納米藥物提供了創新的設計指導。
該研究得到了國家重大研發計劃“納米專項”、國家自然科學基金面上和青年項目、江蘇省杰出青年基金等資助。特別感謝中國藥科大學天然藥物活性組分與藥效國家重點實驗室提供的研究平臺支持。
- 東華大學郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環境調控光熱/催化療法 2025-06-19
- 中科院納米能源所李琳琳團隊 JACS:具有動態活性位點的Ga/Zn雙單原子納米酶提高癌癥治療 2025-05-10
- 浙江省人民醫院孫燚團隊、福州大學張進教授團隊《ACS Nano》:仿生CAT納米酶修飾的光增強復合水凝膠用于級聯調控骨再生 2025-04-12
- 武漢大學張先正教授團隊《Nano Lett.》:微藻基“活”凝膠瘤內光合作用增強腫瘤饑餓/免疫療法 2024-03-16
- 澳門大學代云路課題組 AFM:利用金屬-多酚納米遞送平臺結合可調控的低強度超聲實現腫瘤放療增敏及放療-聲動力聯合療法 2022-07-22
- 浙江大學周民團隊《Sci. Adv.》:活性微藻調節腫瘤乏氧,提高腫瘤聯合治療效果 2020-05-29
