腫瘤微環(huán)境同時(shí)存在血液灌注限制的急性乏氧(perfusion-limited acute hypoxi)和氧氣彌散距離限制的慢性乏氧(diffusion-limited chronic hypoxia)。二者對(duì)于光動(dòng)力學(xué)治療(PDT)的效果均具有明顯的抑制作用。研究者們通常應(yīng)用載氧材料(O2-carrying materials)、光催化產(chǎn)氧材料及微光熱治療單一改善擴(kuò)散型或者灌注型乏氧,以提高腫瘤治療效果。迄今為止,可以同時(shí)改善灌注型乏氧和擴(kuò)散型乏氧的材料與應(yīng)用研究尚未被報(bào)道。
最近,來自中國科大生命科學(xué)學(xué)院的王育才教授以及高分子科學(xué)與工程系的徐航勛教授的研究團(tuán)隊(duì)在Nano Letters上報(bào)道了一種iRGD肽修飾的紅細(xì)胞膜(i-RBM)包被的氧化石墨炔(GDYO)納米片(GDYO@i-RBM),其能通過在腫瘤組織原位產(chǎn)氧和增強(qiáng)血液灌注同時(shí)克服兩種類型的乏氧,從而顯著提高PDT治療的效果(圖1)。
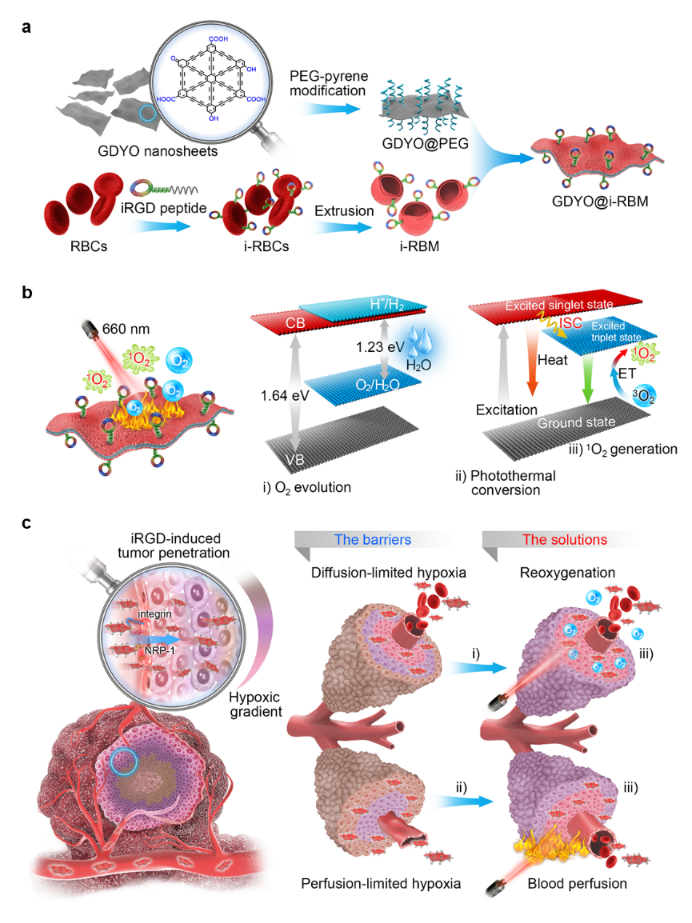
圖1、(a)仿生GDYO納米片的制備過程;(b)光照仿生GDYO納米片的產(chǎn)氧、產(chǎn)1O2及光熱轉(zhuǎn)化機(jī)理圖。(c)仿生GDYO納米片同時(shí)緩解擴(kuò)散型和灌注型乏氧以提高PDT的治療效果示意圖。
研究者首先通過強(qiáng)酸氧化與液相超聲剝離成功制備尺寸120 ± 15 nm,厚度~1.7 nm的GDYO納米片。研究發(fā)現(xiàn),氧化與剝離成功調(diào)控了石墨炔(GDY)的能帶結(jié)構(gòu),明顯降低的價(jià)帶端(VBM)賦予GDYO更高的光氧化熱力學(xué)驅(qū)動(dòng)力,結(jié)合GDYO強(qiáng)的光吸收能力以及超薄的二維結(jié)構(gòu),從而表現(xiàn)出超高的光催化活性。在近紅外光照射下,GDYO納米片同時(shí)表現(xiàn)出優(yōu)異的催化水分解產(chǎn)氧、單線態(tài)氧以及光熱轉(zhuǎn)換性能(圖2)。
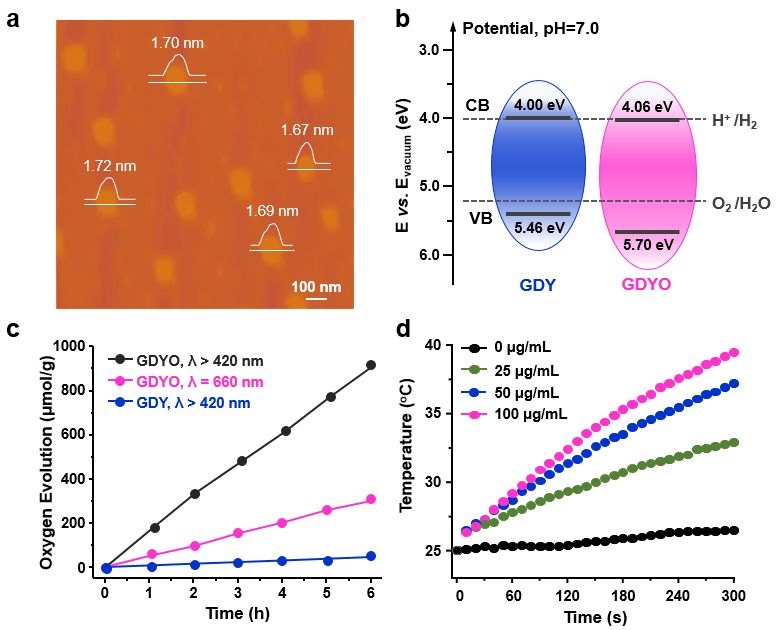
圖2、(a)GDYO納米片的AFM圖像;(b)GDY與GDYO納米片的能帶結(jié)構(gòu)圖;(c)GDY與GDYO納米片光催化產(chǎn)氧性能;(d)GDYO納米片的光熱轉(zhuǎn)換性能。
為了提高GDYO納米片的腫瘤靶向性能力以及生物相容性,該團(tuán)隊(duì)利用iRGD肽修飾的紅細(xì)胞膜(i-RBM)包被GDYO納米片,獲得仿生納米片GDYO@i-RBM。腫瘤組織在注射GDYO@i-RBM納米片并經(jīng)近紅外光照后,腫瘤血管出現(xiàn)明顯的擴(kuò)張現(xiàn)象,擴(kuò)張血管周邊的乏氧信號(hào)(綠色熒光)也隨之明顯減弱(圖3),這是由于i-RBM包被賦予GDYO納米片良好的腫瘤富集及其優(yōu)異的光催化產(chǎn)氧緩解了腫瘤擴(kuò)散型乏氧;與此同時(shí),GDYO的光熱轉(zhuǎn)化功能,能夠有效擴(kuò)張腫瘤血管,增強(qiáng)血液灌注,從而有效克服了灌注型的乏氧。因此,本工作以仿生結(jié)構(gòu)的GDYO納米片為平臺(tái),通過同時(shí)改善擴(kuò)散型乏氧與灌注型乏氧,顯著提高腫瘤PDT治療效果。
該研究以二維共軛微孔聚合物為平臺(tái),通過能帶結(jié)構(gòu)調(diào)控、仿生修飾同時(shí)提升其光催化水分解產(chǎn)氧活性以及靶向能力,并成功應(yīng)用于緩解腫瘤乏氧;也為今后設(shè)計(jì)和合成共軛微孔聚合物納米載體應(yīng)用于緩解擴(kuò)散和灌注限制的腫瘤乏氧提供了新的啟發(fā)。
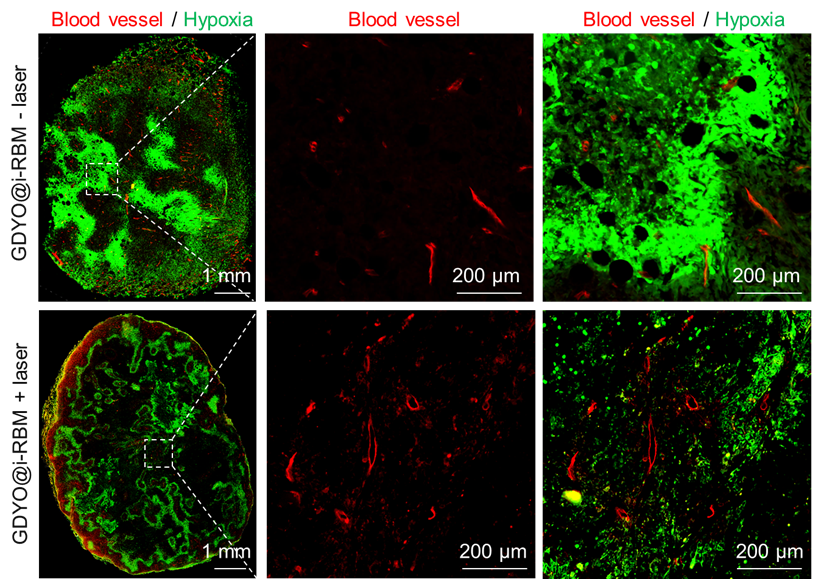
圖3、 腫瘤組織在注射仿生GDYO@i-RBM納米片后,光照前后腫瘤乏氧和血管變化情況。
該工作得到了國家自然科學(xué)基金(NOs. 51773191, 51573176, 51633008,21875235),國家重點(diǎn)研發(fā)計(jì)劃(2017YFA0205600和2017YFA0207301)的資助。
論文題目為“Tumor Reoxygenation and Blood Perfusion Enhanced Photodynamic Therapy using Ultrathin Graphdiyne Oxide Nanosheets。
中國科大博士生蔣為、張震與汪沁同學(xué)為本論文共同第一作者,徐航勛教授與王育才教授為本文的共同通訊作者。
論文鏈接:http://dx.doi.org/10.1021/acs.nanolett.9b01458
王育才教授課題組主頁:http://nanomedicine.ustc.edu.cn/
徐航勛教授課題組主頁:http://staff.ustc.edu.cn/~hxu/
- 東華大學(xué)郭睿教授/史向陽教授課題組《ACS AMI》:樹枝大分子包裹銅鉑雙金屬納米酶用于腫瘤微環(huán)境調(diào)控光熱/催化療法 2025-06-19
- 港中大(深圳)趙征 / 唐本忠團(tuán)隊(duì) ACS Nano :多功能AIE納米馬達(dá)突破腫瘤屏障 - 實(shí)現(xiàn)精準(zhǔn)光診療 2025-05-29
- 山東大學(xué)欒玉霞教授團(tuán)隊(duì) Nat. Nanotech.:發(fā)現(xiàn)解決CAR-T細(xì)胞療法實(shí)體瘤療效受限的有效方法 2025-05-20
- 香港中文大學(xué)(深圳)唐本忠院士團(tuán)隊(duì) ACS Nano:基于AIEgen的可見光穿透器用于深層組織感染的光動(dòng)力治療 2024-10-21
- 吉大楊英威教授、王林教授《Nano Lett.》:新型柱芳烴基共價(jià)有機(jī)骨架材料助力精準(zhǔn)清除牙周致病菌 →放大光動(dòng)力治療效果 2024-10-21
- 仰大勇/劉培峰/姚池合作 AM:DNA納米復(fù)合物用于基因編輯系統(tǒng)和光動(dòng)力治療試劑可控共遞送 2024-01-19
- 武大蔡韜課題組 Macromolecules:光/磁協(xié)同調(diào)控-核殼結(jié)構(gòu)Fe3O4@共軛微孔聚合物催化雙門控ATRP及酶偶聯(lián)應(yīng)用 2025-04-25
