腫瘤放射治療是采用電離輻射針對局部腫瘤進行殺傷的臨床治療手段。然而,放療治療效果往往受到腫瘤放療耐受、照射劑量不足以及治療期間無法實時、快速可視化治療效果等方面的限制。貴金屬納米材料能高效吸收輻射線沉積的輻射能量,可作為放療增敏劑用于增強放療治療效果。然而,這一策略也面臨著腫瘤深部組織滲透的障礙。因此,迫切需要開發能夠促進放療增敏劑腫瘤內滲透,又能實時報告腫瘤放療效果的新型放療策略。
最近,來自中國科大生命科學學院的王育才教授團隊在ACS Nano上報道了一種能夠同時增強主動細胞轉運和被動擴散引起腫瘤深部組織滲透增強的放療增敏劑--金納米顆粒石榴組裝體(RNPs),并能夠實現實時、可視化放療效果的反饋報告。RNPs在中性pH條件下保持穩定的大尺寸以延長血液循環,實現腫瘤部位高效富集;而在腫瘤pH條件下,RNPs內部的酸響應聚合物會發生質子化引起顆粒崩解,釋放出大量的表面正電性的超小金顆粒,其可以借助尺寸和正電荷介導的被動擴散和主動細胞轉運實現腫瘤深層滲透,顯著增敏了腫瘤深部組織的放療(圖1)。根據細胞凋亡過程中caspase-3活化程度,超小金顆粒可釋放其表面被淬滅的熒光分子,快速恢復的熒光反饋信號與細胞凋亡成正相關,進而實現實時熒光定量檢測報告放療效果。

圖1、(A)RNPs組裝體的制備過程;(B)RNPs在腫瘤部位崩解引起組裝體崩解及表面電荷反轉,增強金顆粒擴散的同時促進細胞轉運。(C)RNPs增敏放療促進DNA的損傷并報告凋亡。
研究者首先通過RAFT連續聚合成功制備了酸響應聚合物,將其修飾在金顆粒表面。研究發現,通過精準控制聚合物和金顆粒的比例可以得到不同尺寸、均一且穩定的RNPs組裝體。該納米石榴在中性pH條件下保持穩定的大尺寸;而在腫瘤pH條件下,RNPs內部的酸響應聚合物會發生質子化引起顆粒崩解,釋放出大量的小尺寸和陽離子表面的 Au5(5 nm金顆粒),這種特性使得納米石榴具有很長的體內循環和優異腫瘤主動和被動滲透性能。在滲透進入腫瘤深部之后,金顆粒可以有效增加放療產生的DNA損傷(圖2)。
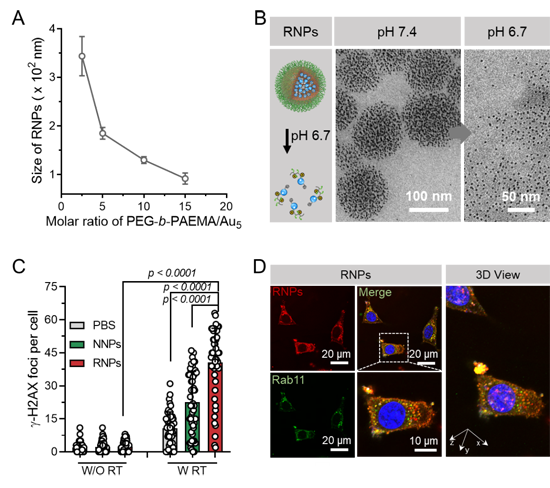
圖2、(A)RNPs的尺寸隨金顆粒和聚合物比例不同下的變化;(B)RNPs在正常pH下和腫瘤pH下的透射電鏡照片;(C)RNPs增敏放療對細胞產生的DNA損傷程度統計;(D)共聚焦檢測RNPs在細胞中和循環內涵體的共定位圖像。
該團隊將RNPs尾靜脈注射進入小鼠體內之后,隨著時間的推移,大部分RNPs迅速穿過腫瘤血管,向腫瘤深部組織發生主動細胞轉運和被動擴散,并逐漸彌散在整個腫瘤組織(圖3)。RNPs的快速滲透一部分是因為其響應腫瘤部位酸度快速崩解后釋放出大量小尺寸的顆粒,加速了腫瘤間隙的擴散;與此同時,RNPs發生表面陽離子化,大量的Au5表面帶有很高的電荷,能夠有效促進細胞轉運引起的主動滲透。因此,本工作以腫瘤響應RNPs組裝體為平臺,促進了放療增敏劑在腫瘤部位的主動和被動雙重滲透,高效增敏了深層腫瘤組織的放療。
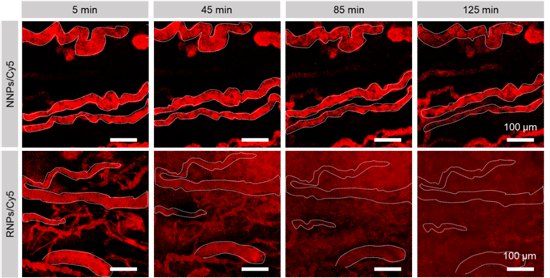
圖3、在尾靜脈注射RNPs之后,RNPs在腫瘤血管周圍的分布隨時間變化。
基于5 nm金顆粒與熒光分子FITC之間存在熒光淬滅效應導致熒光強度降低的原理,研究者設計了實時報告原件并進行組裝得到報告納米石榴(RNPs/FITC),通過監測腫瘤部位熒光信號的強度,可表征caspase-3的含量,從而實現腫瘤凋亡的監測。Au5與熒光分子FITC通過caspase-3響應剪切多肽DEVD鏈接。由于納米顆粒表面能量轉移(NSET)可以響應腫瘤部位caspase-3濃度從而報告腫瘤的凋亡程度。據此,研究者通過監測FITC的熒光強度來判斷腫瘤的治療效果,并可以區分腫瘤的放療耐受性(圖4)。

圖4、(A)5 nm金顆粒和FITC之間的NSET機理圖,在caspase-3條件下,DEVD多肽被剪切,FITC釋放之后熒光恢復;(B)RNPs/FITC在和Caspase-3孵育之后不同時間點的熒光光譜;(C)活體顯微成像系統檢測EMT6腫瘤放療效果的報告熒光圖像;(D)活體顯微成像系統檢測不同放療敏感度的腫瘤在不同劑量下的報告熒光圖像。
該研究以腫瘤酸響應聚合物和金顆粒為平臺,通過精準、可控自組裝、搭載可視化報告原件增強腫瘤部位雙重滲透并快速檢測治療效果,成功應用于增敏深層次腫瘤組織放療;也為今后設計和合成納米放療增敏劑應用于深層次腫瘤組織放療提供了新的設計思路。
中國科大王立、蔣為博士與安徽醫科大學第一附屬醫院肖亮醫生為本論文共同第一作者。
該工作得到了國家自然科學基金(NOs. 91942310, 51961145109, 51773191),國家重點研發計劃(2017YFA0205600)的資助。
論文信息:“Self-Reporting and Splitting Nano-Pomegranates Potentiate Deep Tissue Cancer Radiotherapy via Elevated Diffusion and Transcytosis”
https://doi.org/10.1021/acsnano.0c02674
- 東華大學史向陽教授課題組在樹狀大分子納米探針用于T細胞監測上取得新進展 2020-03-29
- 四川大學丁明明教授團隊 Angew: 可視化β折疊到β轉角構象轉變的熒光聚合物囊泡及其用于顏色報告型藥物遞送 2025-07-11
- 中山大學顧林課題組 CEJ:利用熒光猝滅實現環氧防腐涂層中石墨烯宏觀分散的可視化與定量評估 2025-07-08
- 化學所陳傳峰、韓瑩團隊 Angew:基于杯[3]二氫吖啶與受體鍵連聚合物超分子TADF材料的構筑及在痕量苯快速可視化檢測中的應用 2025-05-15
- 澳門大學代云路課題組 AFM:利用金屬-多酚納米遞送平臺結合可調控的低強度超聲實現腫瘤放療增敏及放療-聲動力聯合療法 2022-07-22
- 浙江大學周民團隊、哈佛大學陶偉團隊《Nat. Commun.》微藻放療保護口服藥物遞送系統用于腫瘤放療中腸道輻射防護和菌群調節 2022-03-20
