在腹腔/盆腔腫瘤的放射治療中,正常腸道組織會不可避免地受到輻照的損傷,進而導致消化系統功能障礙甚至死亡。由于放療輻照范圍因人而異,小腸的受損部位也難以預測,因此對小腸全長的全面輻射防護是一個亟待解決的問題。氨磷汀(Amifostine,AMF)是唯一被美國食品藥品管理局(FDA)批準用于臨床的輻射防護藥物,可選擇性保護正常組織免受輻射損傷,但其由于易于代謝、酸性失活等缺陷,僅被用于靜脈給藥,難以應用于腸道輻射防護,因此,開發克服該藥物口服障礙的給藥策略,將有希望實現對腸道的有效輻射防護。
近日,浙江大學周民教授團隊聯合哈佛大學醫學院陶偉教授團隊,在上述問題的研究中取得新進展,在Nature Communications發表題為Microalgae-based oral microcarriers for gut microbiota homeostasis and intestinal protection in cancer radiotherapy的研究論文。該研究利用一種可食用的天然微藻,螺旋藻,通過簡易的脫水-復水化策略,裝載輻射防護藥物氨磷汀,制備用于口服的藥物遞送系統(SP@AMF),以保護藥物不被胃酸滅活,并通過腸道長時間滯留和藥物緩釋,實現在小腸各段均勻的高濃度藥物分布,從而有效保護小腸全長免受輻照損傷。

圖1基于天然微藻的口服藥物遞送系統的合成步驟及其腸道輻射防護作用原理
該口服藥物遞送系統可在胃酸中有效保護藥物活性,其200-500微米級別尺寸以及螺旋形態有助于其在腸絨毛間的滯留和藥物緩釋;該系統可隨胃腸道消化作逐漸破碎,有助于藥物在腸道的充分釋放及分布。

圖2 螺旋藻放療藥物遞送系統可以實現更全面的腸道長滯留和高攝取,全方位保護腸道放療損傷
相比游離藥物及其腸溶膠囊,該口服遞送系統表現出更全面、更優越的腸道防護效果。在原位結腸癌放療模型中,該系統表現出對正常腸道的選擇性保護,不影響腫瘤的輻照殺傷。此外,基于螺旋藻本身的菌群調節作用,該系統有利于維持輻照后的腸道菌群平衡,有助于營養吸收及輻照損傷的恢復。
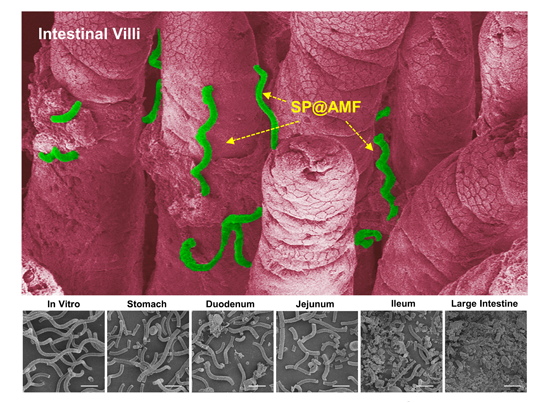
圖3 在遞送系統在腸絨毛間的滯留及在消化道各部位的逐級降解
腸道輻射損傷是臨床常見的放療不良反應,嚴重損害腫瘤放療效果和患者的生存質量,針對這一問題,具有臨床轉化潛能的新型材料或藥物遞送系統仍較為缺乏。本研究基于可再生天然微藻的口服給藥系統,不僅易于低成本制備和量產,而且效果優于常見商業化口服材料,展現出較大的臨床轉化及應用潛力。
浙江大學轉化醫學研究院周民團隊博士生張東曉、浙江大學轉化醫學研究院周民團隊博士生鐘丹妮和哈佛大學醫學院Jiang Ouyang是論文的共同第一作者,浙江大學周民研究員,哈佛大學醫學院陶偉教授和哈佛大學工程與應用科學學院Xingcai Zhang為論文的共同通訊作者。研究工作得到了國家自然科學基金、浙江省重點研發計劃專項等項目資助。
原文鏈接:https://www.nature.com/articles/s41467-022-28744-4
- 浙江大學周民團隊《ACS Nano》:微藻-胰島素復合口服遞送系統 2023-07-07
- 浙江大學周民團隊 ACS Nano:口服微藻-納米復合遞送系統預防放射性損傷 2023-06-01
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統"降尿酸-抗炎-消化系統保護"三位一體協同用于痛風性關節炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
- 華東理工劉潤輝教授、葉邦策教授 AHM:新型口服遞送系統包封智能工程菌用于炎癥性腸病治療 2024-12-20
- 清華大學張明君教授和徐靜副教授團隊 Sci. Adv.:腸驅動仿生微針機器人用于生物類藥物無痛口服遞送 2024-01-11
