鐵死亡是一種鐵離子依賴的調控性細胞死亡形式。由于其能夠調控細胞內氧化還原穩(wěn)態(tài),促進氧化應激,改變細胞膜和亞細胞器膜流動性和完整性,對腫瘤干細胞和具有上皮間質轉化特征的耐藥細胞具有毒性作用,近年來被廣泛用于治療各類(難治性)腫瘤。然而,鐵死亡抗腫瘤療法具有細胞選擇性,人乳腺癌細胞(MCF-7和T-47D)、人前列腺癌細胞(LNCaP) 和人髓性白血病細胞(K562) 等對鐵死亡沒有應答,這主要是由于細胞內長鏈脂酰輔酶A合成酶4 (ACSL4)的低表達或沒有表達。因此,解決ACSL4缺乏腫瘤細胞的鐵死亡耐藥性具有重要臨床價值。
近日,天津大學藥學院趙燕軍教授、王征教授聯(lián)合天津醫(yī)院田愛現(xiàn)博士利用兩親性二茂鐵高分子來共遞送鐵死亡誘發(fā)劑 (金諾芬) 和鐵死亡增敏劑,即花生四烯酸-磷脂酰乙醇胺 (PE-AA) (圖1)。二茂鐵高分子具有雙重功效,既可以在腫瘤細胞內高濃度過氧化氫條件下釋放負載物,又可以釋放鐵離子來增敏細胞鐵死亡。金諾芬是一種FDA批準的小分子化合物,其通過靶向硫氧還蛋白還原酶來間接誘發(fā)鐵死亡。PE-AA的過氧化物及過氧自由基是細胞鐵死亡的執(zhí)行分子,直接遞送PE-AA可有效逆轉ACSL4缺乏導致的鐵死亡耐藥性 (圖2)。PE-AA和金諾芬共遞送膠束在MCF-7荷瘤小鼠模型中表現(xiàn)出優(yōu)異的抑瘤性能,顯著提高了動物生存率 (圖3)。腫瘤組織標記物分析顯示共遞送膠束可高效誘發(fā)MCF-7腫瘤細胞的脂質過氧化和鐵死亡 (圖4)。該工作以“Reversing Ferroptosis Resistance in Breast Cancer via Tailored Lipid and Iron Presentation”為題發(fā)表在《ACS Nano》雜志,天津大學藥學院博士生羅佳佳同學為論文第一作者。
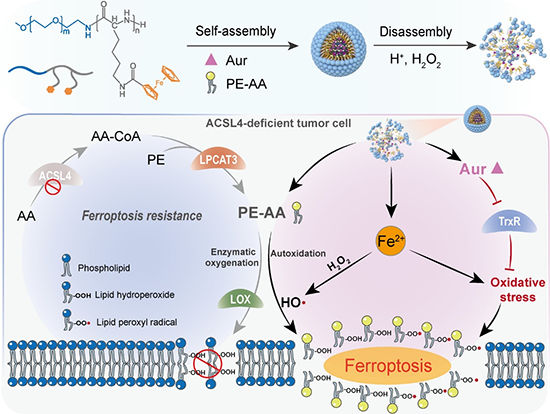
圖1. PE-AA/金諾芬共遞送膠束逆轉鐵死亡耐藥示意圖。

圖2. 特異性磷脂PE-AA增敏金諾芬誘導的MCF-7細胞鐵死亡。
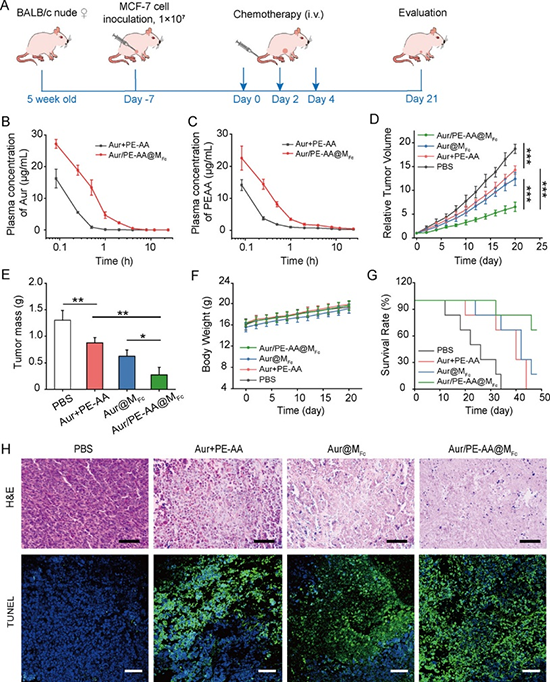
圖3. PE-AA/金諾芬共遞送膠束的體內抗腫瘤藥效。
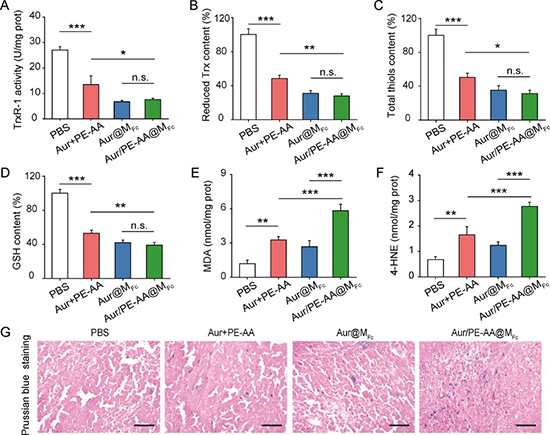
圖4. PE-AA/金諾芬共遞送膠束高效誘發(fā)MCF-7腫瘤細胞鐵死亡。
天津大學藥學院趙燕軍/王征團隊聚焦基于細胞死亡機理的藥物遞送基礎與轉化研究,用于耐藥腫瘤、炎癥、缺血再灌注、神經退行性疾病、老年相關眼科及骨科疾病等的防治。近年來課題組代表性工作包括 ACS Nano, 2023, 17, 12127;Adv Funct Mater,2023, 33,2300689 ; Adv Funct Mater,2022, 32, 2112000;Adv Funct Mater,2021, 31, 2009157; ACS Nano,2020, 4, 14715;Nano Lett,2020, 20, 6235; Nano Lett,2019, 19, 7866; Biomaterials, 2019, 223, 119486。
該工作是團隊在細胞鐵死亡藥物遞送領域的最新進展之一,更多信息見課題組主頁:https://www.x-mol.com/groups/dds
論文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.3c08485
- 煙臺大學/濰坊中醫(yī)藥產研院陳大全教授團隊 JCR: 仿生活性氧/氮納米清除劑抑制“鐵死亡風暴”調節(jié)免疫靶向急性腎損傷 2025-01-10
- 南方醫(yī)大沈折玉教授 Biomaterials: 中空介孔三氧化二鐵納米藥物介導的瘤內Fe3+/2+循環(huán)催化用于大腫瘤鐵死亡治療 2024-11-01
- 南華大學喻翠云/魏華/張海濤團隊 JNB:調控組氨酸磷酸酶-鐵死亡串擾 - 用于肝細胞癌高效治療及其機制的研究 2024-10-18
- 山東大學崔基煒教授團隊 ACS Nano: 硬度可調的聚乙二醇納米顆粒調節(jié)納米-生物相互作用,增強靶向藥物遞送 2025-06-12
- 浙大周民教授團隊 Bioact. Mater.:微藻藥物遞送系統(tǒng)"降尿酸-抗炎-消化系統(tǒng)保護"三位一體協(xié)同用于痛風性關節(jié)炎的治療 2025-06-04
- 蘇大劉莊/楊光保教授團隊招聘博士后 - 材料合成、納米醫(yī)學(腫瘤診療、藥物遞送、免疫治療等) 2025-04-29
