細胞內細菌感染與許多嚴重感染疾病相關,如肺結核、心內膜炎、骨髓炎、壞死性肺炎和敗血癥等。臨床治療難以根除胞內菌,主要原因包括:(i)抗生素的細胞膜穿透性差,胞內積累少,保留時間短;(ii)溶酶體內苛刻的酸性和水解環境降低了抗生素的抗菌活性;(iii)休眠狀態的胞內菌對致命濃度的抗生素具有耐受性;(iv)細菌從溶酶體中逃脫并隱藏在細胞質內,逃避抗生素的清除作用。為了對抗這些頑固的細菌,通過精準靶向胞內菌,將抗生素遞送到細菌駐留部位是一種可行的方法,但相關研究仍鮮有報道。
為此,北京化工大學生命科學與技術學院王興教授課題組巧妙地設計了一種新型的具有級聯靶向功能的藥物遞送系統(FAM DDS),該DDS通過級聯靶向巨噬細胞和胞內耐甲氧西林金黃色葡萄球菌(MRSA),實現抗生素利福平(Rif)的原位精準遞送,克服了頑固胞內菌休眠狀態及隱匿位置削弱抗生素性能的瓶頸問題。與此同時,Rif@FAM能夠上調巨噬細胞M1/M2極化,增強巨噬細胞免疫清除作用,協同Rif實現細胞內MRSA的高效清除(圖1)。
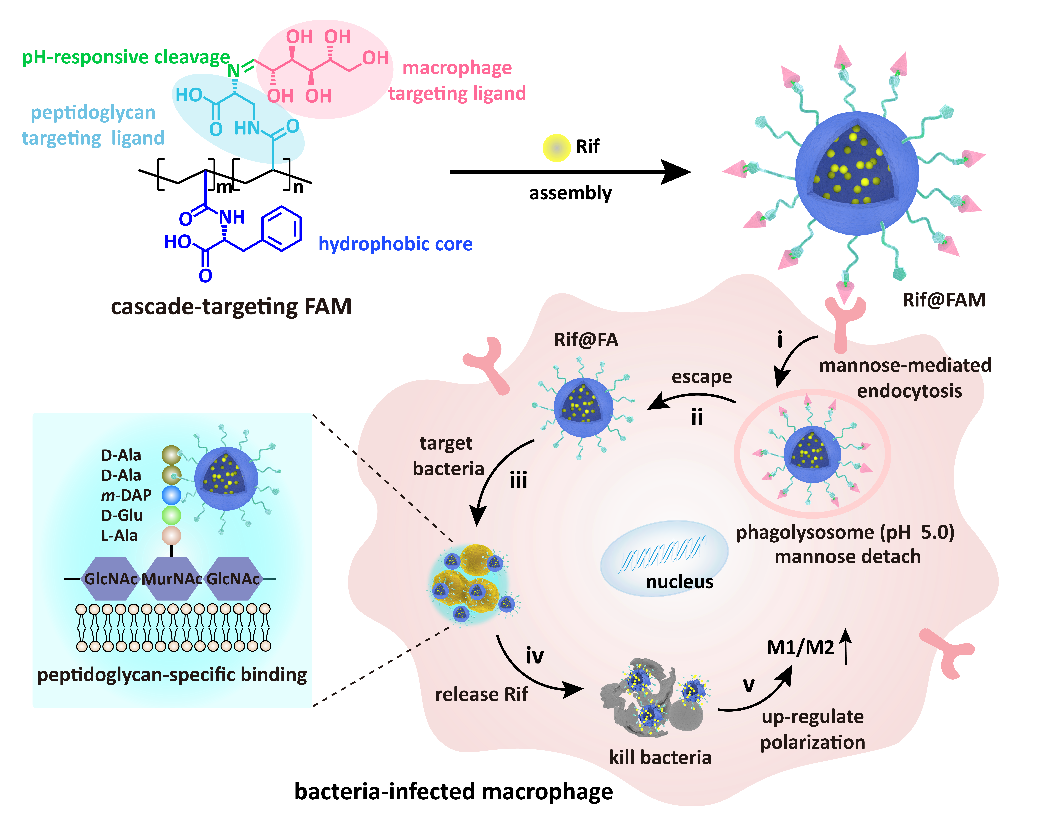
圖1:Rif@FAM級聯靶向清除巨噬胞內MRSA
文章要點:
(1)Rif@FAM DDS的設計合成。課題組首次以β-N-丙烯酰基-D-氨基丙氨酸作為主要功能單體,通過光誘導聚合技術合成了特異性靶向細菌的聚合物FA,并利用動態席夫堿鍵接枝甘露糖獲得具有靶向巨噬細胞能力的聚合物FAM,進而自組裝包載Rif,構建了具有級聯靶向胞內菌功能的Rif@FAM DDS(圖2)。該策略為DDS提供了高密度的胞內菌靶向基團,有利于降低脫靶率;而且,氨基酸聚合物豐富的非共價相互作用力,提高了DDS的藥物裝載效率(18.9 wt%)和酸穩定性,實現了持續1個月的長效藥物釋放性能。
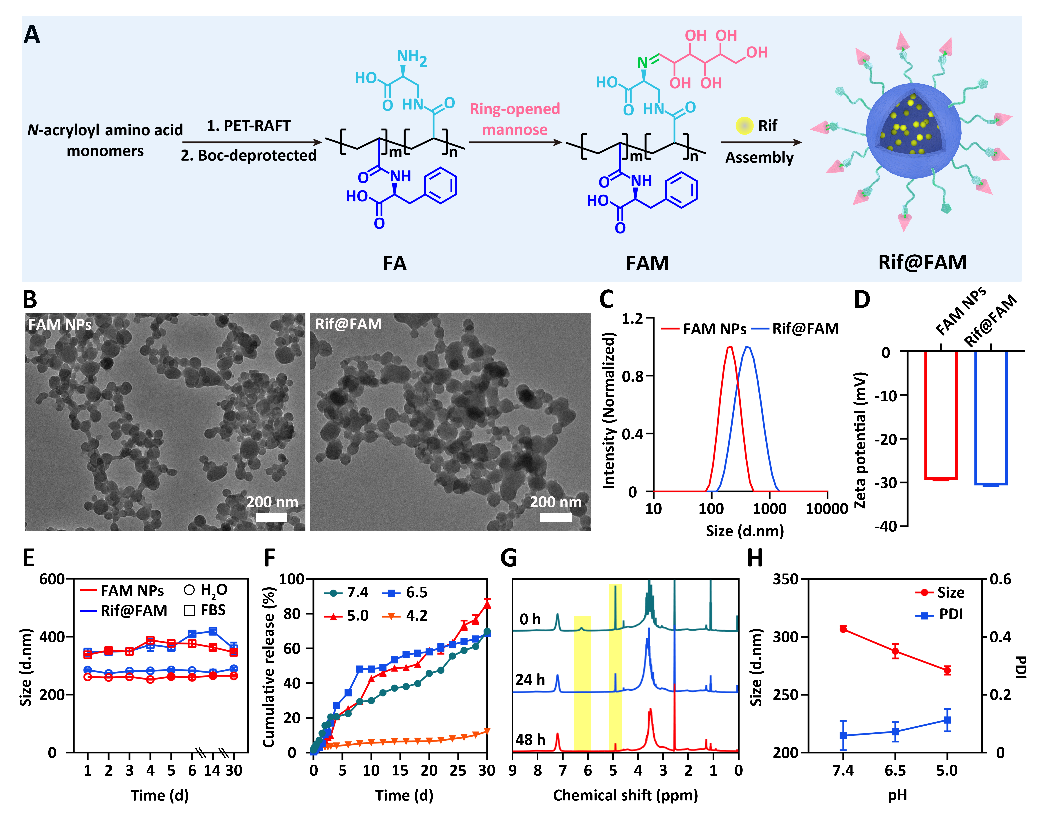
圖2:Rif@FAM DDS的合成和表征
(2)級聯靶向機制。研究表明,Rif@FAM首先通過甘露糖受體介導細胞內吞,選擇性地進入巨噬細胞,增加了Rif在胞內的富集;隨后,在溶酶體酸性環境下斷開席夫堿鍵,觸發甘露糖脫離形成Rif@FA;Rif@FA表面暴露的D-氨基丙氨酸促發粒子從溶酶體內逃逸,并特異性結合到胞內MRSA的細菌壁上,從而實現了級聯靶向作用。作者通過原位/非原位共定位手段論證了FAM DDS對胞內MRSA的特異性靶向作用(圖3)。三維共聚焦成像顯示,FAM DDS與胞內MRSA熒光高度重合。流式細胞儀定量分析顯示,細胞裂解后收集得到的胞內MRSA與FAM重合度高達71.6%,比空白組高約3倍,表明高密度D-氨基丙氨酸增強了FAM DDS和細菌的結合能力,有效避免了脫靶效應。原位TEM成像進一步證明,FAM DDS結合在胞內MRSA細胞壁上,與對照組中胞內MRSA光滑的細胞壁形成了鮮明對比。

圖3:FAM DDS靶向細內菌
(3)體內抗菌活性。受試小鼠經尾靜脈注射FAM DDS后,FAM DDS可在24 h內聚集在MRSA感染部位,進一步證明了FAM DDS在動物水平可實現藥物的原位遞送(圖4)。進而,作者以單一功能的細胞靶向DDS(Rif@FM)和細菌靶向DDS(Rif@FA)為對照,研究了Rif@FAM對小鼠急性腹膜炎的治療效果。統計數據顯示,Rif@FAM實驗組的胞內MRSA數量 (1.36 log10CFU) 顯著低于對照組 Rif@FA (2.18 log10CFU; **, p = 0.004) 和 Rif@FM (3.24 log10CFU; ***,p = 0.0004)。結果表明,相比于單一細胞靶向和細菌靶向的DDS,FAM DDS的級聯靶向與原位藥物遞送特性能夠顯著提升抗生素的治療效果。

圖4:FAM DDS的體內靶向和抗菌性能評價
綜上所述,Rif@FAM通過級聯靶向和原位藥物遞送,實現了胞內菌的高效清除。它的主要優勢有:(i)實現了Rif較高的胞內積累和長時間胞內保留;(ii)強酸下結構穩定,具有長效的抗菌活性;(iii)原位精確釋放Rif,克服胞內菌休眠狀態及隱匿位置削弱抗生素性能的瓶頸問題;(iv)重塑了巨噬細胞的免疫反應,增強了抗菌性能。研究工作論證了級聯靶向和原位遞送策略對殺滅胞內菌的作用和意義,為相關疾病的治療提供了新方法和新技術。
相關研究成果近期以“Cascade-targeting Poly(amino acid) Nanoparticles Eliminate Intracellular Bacteria via on-site Antibiotic Delivery”為標題發表在Advanced Materials雜志上 (IF = 30.849)。本論文第一作者為北京化工大學生命科學與技術學院博士研究生馮文麗。北京化工大學王興教授、李國鋒副教授為論文的共同通訊作者。該研究得到國家自然科學基金、國家創新藥物重大專項、中央高校基礎研究基金和北京市自然科學基金的資助與支持。
文章鏈接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202109789
- 寧波大學陳重一教授 ACS Macro Lett.:基于螺旋結構聚氨基酸的強力生物粘合劑 2025-03-07
- 北化徐福建/趙娜娜/申鶴云《ACS Nano》:兩親性聚氨基酸納米佐劑介導的光熱增強免疫治療 2024-11-13
- 長春應化所陳學思/宋萬通團隊《Mater. Horiz.》:基于聚氨基酸的脾靶向遞送mRNA的磷脂酰聚合物文庫 2024-04-03
- 東華大學史向陽教授團隊 AS:氧化還原響應型樹狀大分子納米凝膠通過內質網應激放大和巨噬細胞極化實現超聲增強的胰腺癌化學免疫治療 2023-06-25
- 北科大鄭裕東教授、上海長海醫院朱世輝教授 CEJ:基于協同策略構建的具有自負壓層級吸滲、抗炎和抗菌的水-氣雙相凝膠慢性傷口敷料 2022-09-21
- 中山大學吳玫穎/中國醫學科學院生物醫學工程研究所梅林 Adv. Sci.:聚吡咯納米酶調控腫瘤相關巨噬細胞極化以增強免疫治療 2022-06-23
