炎癥性腸病(IBD)是一種涉及回腸、結腸和直腸的慢性腸道炎癥,包括潰瘍性結腸炎和克羅恩病,未能及時進行干預和治療可能最終導致致癌或危及生命的并發癥。工程菌療法在治療胃腸道疾病具有巨大的潛力,但其直接使用時會因強酸性胃液環境大量失活,且難以實現腸道定殖。因此,發展生物相容性好,能夠耐受胃內強酸性環境,實現長時間腸道定殖的遞送系統,對工程菌治療IBD具有重要潛力。
針對以上挑戰,劉潤輝教授和葉邦策教授合作研發了一種治療IBD的新策略,葉邦策教授課題組開發了一種針對IBD的智能工程菌,劉潤輝教授課題組設計了一種黏液包封凝膠微球(mucus encapsulated microsphere,MM)遞送系統。MM遞送系統封裝工程菌,維持工程菌在胃內的活力和腸道定殖,實現工程菌高效遞送到病灶部位,且不影響生物標志物的進入和蛋白藥物的釋放,在炎癥性腸病模型中表現出顯著的診斷和治療效果,為活體生物治療產品向臨床應用提供新的思路。
2024年12月4日,該研究成果以“Delivery of Encapsulated Intelligent Engineered Probiotic for Inflammatory Bowel Disease Therapy”為題發表在Advanced Healthcare Materials上(Adv. Healthcare Mater. 2024, 2403704. DOI: 10.1002/adhm.202403704)。
劉潤輝教授課題組前期研究發現的聚絲氨酸(PSer)材料具有優異的生物相容性,不引起明顯的體內炎癥反應和異物反應(Angew. Chem. Int. Ed. 2020, 59, 9586- 9593;Nat. Commun. 2021, 12, 5327;Adv. Funct. Mater. 2021, 31, 2007226)。作者將PSer引入到海藻酸(ALG)中,制備ALG-PSer(PA)凝膠微球包封工程菌。進一步地,制備表沒食子兒茶素沒食子酸酯(EGCG)和透明質酸(HA)組成的黏液層(EH),構建基于黏液-微球的MM遞送系統(圖1)。EGCG具有抗炎特性和表面黏附能力,HA具有優異的生物相容性和黏附性。MM遞送系統能夠有效保護工程菌抵御胃內的強酸性環境,顯著提高工程菌在腸道的黏附,定殖時間超過20 h,且不影響生物標志物的進入和治療性免疫調節蛋白Avcystatin的釋放,在炎癥性腸病動物模型中表現出優異的診斷和治療效果。
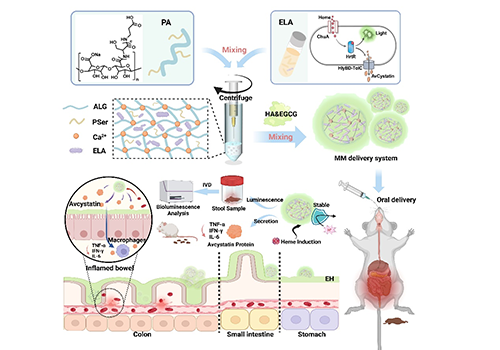
圖1. IEP-MM設計原理圖
本研究以益生性大腸桿菌Nissle 1917(EcN)作為底盤,開發用于診斷和治療IBD的智能工程菌。該工程菌能夠靈敏的感知IBD標志物血紅素,產生生物發光的同時自調控的分泌AvCystatin用于疾病干預。為了實現對血紅素介導的生物發光和治療劑表達的精確控制,研究者對工程菌的功能元件進行了一系列迭代優化。最終,獲得了名為EcN-LuxC-AvCys(ELA)的工程菌(圖2A),其可以靈敏的感知血紅素并自調控的分泌AvCystatin,檢測限低于0.625 μM,最大誘導比167倍(圖2B)。ELA發光響應的動力學顯示,在血紅素暴露后20分鐘內信號快速放大,在120分鐘時達到峰值(圖2C)。成像結果和蛋白質印跡(WB)分析表明,生物發光強度及治療蛋白的分泌水平和血紅素濃度呈正相關(圖2D)。此外,酶聯免疫吸附測定(ELISA)結果表明AvCystatin的最大分泌量達到150 ng/mL(圖2E)。這些結果表明成功構建了一種名為ELA的血紅素響應型工程益生菌菌株,該菌株能夠靈敏的感知血紅素,產生強大的發光信號產生并自調控的釋放治療蛋白。
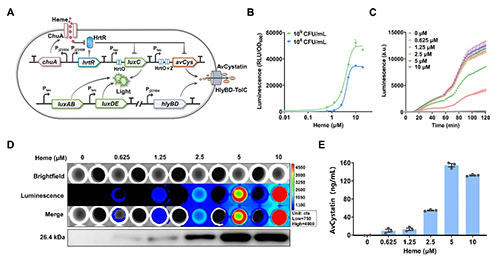
圖2. 血紅素反應型智能工程菌的設計與表征
作者合成了聚DL-絲氨酸(PSer, Mn = 3700 Da, DP = 18, D = 1.12),然后以2-氯-4,6-二甲氧基-1,3,5-三嗪(CDMT)和N-甲基嗎啉(NMM)為偶聯劑將PSer偶聯到海藻酸鈉上,進一步通過Ca2+交聯法制備成微球并包封工程菌,微球呈橢球狀,粒徑分布均勻(圖3A-E)。掃描電鏡(SEM)圖像進一步顯示了工程菌在水凝膠微球內的有效封裝(圖3F)。模擬胃液(SGF)和模擬腸液(SIF)處理2小時后,ELA@PA組的存活率達到82.7%,而未封裝ELA組的存活率僅為4.11%(圖3G)。隨著SIF中孵育時間的增加,PA包封對ELA的保護作用更加明顯,6 h時的存活率比未包封的細菌高23%(圖3I)。連續暴露于模擬消化液后,PA的穩定包封使細菌存活率提高了約60%,表明其對ELA的保護作用增強(圖3J)。體外黏附性能研究顯示,PA+EH遞送系統在豬結腸黏膜表面非常緩慢地向下流動,表現出很強的黏附性(圖3K)。此外,PA+EH的包埋也不影響血紅素與ELA的相互作用(圖3L)。總之,PA+EH的包封可以在SGF或SIF環境中長時間保護工程菌,并維持細菌的應答能力。

圖3. EH黏液包封PA微球凝膠給藥系統的制備與表征
為進一步評估遞送體系的體內定植效果,作者分別讓小鼠口服Cy5、ELA以及PA+EH包封的Cy5。成像分析顯示PA+EH在體內的腸道滯留時間延長,超過20小時(圖4A)。隨后,我們對ELA@PA+EH的生物相容性和生物安全性進行了綜合評價。細胞毒性實驗結果表明,PA+EH包封顯著降低了巨噬細胞對細菌的免疫識別(圖4B)。給藥5天,實驗組和對照組之間小鼠體重、肝功能相關酶和細胞因子沒有顯著差異,H&E結腸組織切片未見免疫細胞浸潤或其他炎癥改變(圖4C-F)。此外,作者還研究了ELA@PA+EH對小鼠腸道菌群的影響。結果顯示ELA@PA+EH不會影響小鼠物種豐富度和多樣性(圖4G)。同時,有益菌群的比例,如擬桿菌門(Bacteroidota)、厚壁菌門(Firmicutes)、放線菌門(Actinobacteroidota)與對照組相當(圖4H)。PA+EH獨特的體內滯留特性和良好的生物相容性為胃腸道治療提供了一種有潛力的遞送系統。

圖4. EH黏液腸道黏附試驗及遞送系統安全性評價
腸出血的檢測在監測IBD的發生和發展中起著至關重要的作用。為了評估ELA@PA+EH連續監測小鼠腸道炎癥進展的能力,作者建立了兩個模型,在小鼠結腸炎加重模型中(圖5A),DSS給藥第3天,發光信號顯著增加,且隨著疾病活動指數(DAI)的進展,發光信號繼續增加(圖5B、C)。接下來通過小鼠結腸炎緩解模型,繼續研究ELA@PA+EH監測結腸炎恢復的能力(圖5D)。結果顯示ELA@PA+EH能有效檢測小鼠結腸炎恢復期胃腸道出血減少情況(圖5E、F)。

圖5. ELA@PA+EH檢測結腸炎小鼠腸道出血
基于ELA的治療性蛋白的表達能力以及MM遞送系統提供的有效保護功效和腸道黏附能力,作者通過小鼠結腸炎緩解模型評估ELA@PA+EH在緩解DSS誘導的急性結腸炎方面的療效(圖6A)。與PBS(DSS+)組相比,ELA@PA+EH治療顯著減輕了小鼠體重下降,并伴有明顯的疾病指數DAI的降低(圖6B),而ELA組和EH組在DAI方面與PBS(DSS+)組相比沒有改善(圖6C)。此外,ELA@PA+EH(DSS+)組的結腸長度與健康小鼠相當,明顯長于其它治療組(圖6D,E)。這些研究結果表明ELA@PA+EH與單純ELA或EH治療相比,在改善急性結腸炎方面有顯著的療效。結腸組織H&E染色顯示ELA@PA+EH(DSS+)組與健康組相似,腸道結構完整,杯狀細胞豐富,無炎癥異常。而缺乏工程菌和MM遞送系統均未顯示粘膜上皮受損,淋巴細胞浸潤,腸腺和杯狀細胞數量減少(圖6F)。此外,對結腸組織樣本中促炎細胞因子(IFN-γ、IL-6和TNF-α)水平的評估顯示,ELA@PA+EH(DSS+)組的細胞因子濃度顯著低于PBS(DSS+)和EH組(DSS+)組(圖6G-I)。有趣的是,ELA@PA+EH(DSS+)組和ELA(DSS+)組之間的促炎細胞因子水平無顯著差異,這可能歸因于EcN底盤和AvCystatin的抗炎特性。此外,作者還分析了第5天收集的糞便樣本中的16S rRNA。PCoA和NMDS分析結果顯示,與其他治療相比,ELA@PA+EH治療的結腸炎小鼠腸道菌群組成的β多樣性更接近于健康組(圖6J,K)。此外,ELA@PA+EH組顯示有益菌的比例增加,有害菌比例下降(圖6L,M)。這些發現均強調了ELA@PA+EH對IBD小鼠腸道微生物結構的有效治療。
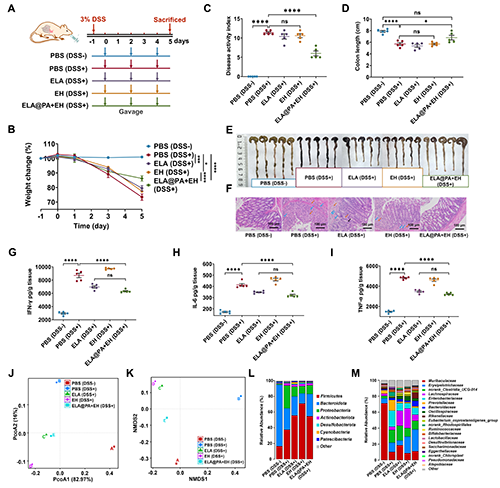
圖6. ELA@PA+EH對DSS誘導小鼠結腸炎的緩解作用
作者進一步利用DSS誘導的小鼠結腸炎治療模型,研究ELA@PA+EH的治療效果(圖7A)。到第5天,所有DSS處理組的體重都減少了大約10%。然而,在治療后兩天內,ELA@PA+EH(DSS+)組的體重減輕速度減慢,體重迅速恢復,到第五天達到與健康組相當的水平(圖7B)。此外,ELA@PA+EH(DSS+)組DAI較低,與健康PBS(DSS-)組無顯著差異。結腸成像顯示,ELA@PA+EH(DSS+)組的結腸長度比健康小鼠的結腸長度少1/2,且明顯長于PBS(DSS+)組。結腸組織樣本的細胞因子檢測顯示,ELA@PA+EH(DSS+)組與對照組相比無顯著差異(圖7E-G)。值得注意的是,與ELA@PA+EH(DSS+)組和ELA(DSS+)組在腸炎緩解實驗中細胞因子水平無顯著差異不同,在該治療模型中,ELA@PA+EH(DSS+)組在促炎因子水平上與ELA(DSS+)組有顯著差異。這種差異可能是由于治療實驗中灌胃次數減少所致。從這個角度來看,ELA@PA+EH的優勢是顯而易見的,因為它可以有效地抵御胃腸道的挑戰,延長細菌定植時間,從而減少給藥頻率,從而減輕患者的負擔。同樣,PCoA和NMDS分析表明,ELA@PA+EH處理的結腸炎小鼠腸道微生物組成與健康小鼠相近(圖7H,I)。ELA@PA+EH導致有益菌水平升高,有害菌水平降低(圖7J,K)。這些結果表明,ELA@PA+EH處理抑制了有害微生物種群,同時為有益菌提供了更多的生存資源和環境生態位,從而促進了腸道微生物的穩態。總之,該研究結果為ELA@PA+EH通過調節腸道菌群多樣性和恢復結腸炎小鼠有益菌和致病菌之間的平衡,在結腸炎治療中的治療潛力提供了令人信服的證據。
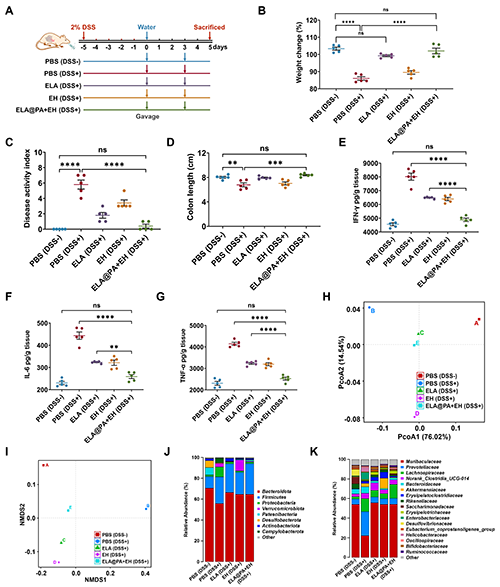
圖7. ELA@PA+EH對小鼠DSS性結腸炎的治療作用
華東理工大學博士后鄒振平、碩士研究生蔡志豪和張小芃是該論文的第一作者,華東理工大學葉邦策教授、劉潤輝教授、周英教授和張東輝特聘副研究員是通訊作者。該研究得到了國家自然科學基金委、科技部等基金的資助。
論文鏈接:https://doi.org/10.1002/adhm.202403704







