骨組織獨特的生理環境為骨轉移相關疾病的治療帶來了重大挑戰,尤其現有的核酸遞送系統,如脂質納米顆粒(LNP)和聚乙烯亞胺(PEI),難以實現精準的骨靶向,嚴重限制了核酸藥物在骨科領域的應用。
為應對上述挑戰,同濟大學杜建忠教授/朱云卿研究員和同濟大學附屬第十人民醫院骨科賀石生教授在此前聚酰胺胺Pabol的研究基礎上(Chem. Mater. 2024, 36, 5422-5435.),進一步引入骨親和分子阿侖膦酸(ALN),成功設計了一種新型骨靶向核酸遞送載體——聚[阿侖膦酸-co-(N,N′-雙(丙烯酰)胱胺-co-4-氨基-1-丁醇)](ALN-Pabol)。該載體不僅能精準遞送miRNA至骨轉移瘤區域,還具備生物可還原、可降解、高包封效率、低毒性等優勢,為骨組織疾病的核酸治療提供了新策略。
具體研究思路如圖1所示:ALN-Pabol通過靜電作用與治療性miRNA結合,形成穩定的ALN-Pabol/miRNA納米復合物。該復合物在ALN的引導下精準定位骨組織,并在腫瘤高谷胱甘肽環境中響應性釋放miRNA,激活抑癌基因GPER1以抑制腫瘤增殖并促進其凋亡。同時,ALN通過抑制破骨細胞活性緩解乳腺癌骨轉移相關的溶骨性損傷,以此實現抗腫瘤+抗骨吸收雙重療效。
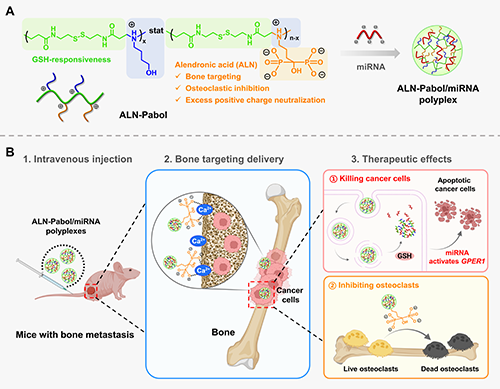
圖1. 骨靶向ALN-Pabol/miRNA納米復合物的制備以及其用于治療乳腺癌骨轉移瘤和相關溶骨性破壞的示意圖。
為了避免納米復合物由于粒徑過小而被腎臟清除、提升其在腫瘤組織中的滲透性和滯留能力,納米復合物的粒徑范圍需要控制在50~500 nm范圍內,且確保粒徑分布均勻。此外,納米復合物表面的正電荷對核酸遞送效率有重要影響:較高的正電荷有助于提高細胞攝取率和轉染效率,但也可能導致更高的細胞毒性,因此需在效率與生物安全性之間取得平衡。為了實現對粒徑與電荷的精準調控,團隊優化了多個制備參數,包括聚合物與miRNA的質量比、緩沖液pH值、miRNA濃度、滴定速度及混合過程中的攪拌速度,最終成功制備出具備理想粒徑、粒徑分布及表面電荷特性的ALN-Pabol/miRNA納米復合物(圖2A, B)。通過透射電子顯微鏡(TEM)表征了納米復合物的結構(圖2C)。包封效率測定結果顯示,Pabol、ALN0.1-Pabol和ALN0.2-Pabol的包封效率分別為91.7%、94.9%和96.8%,均超過90.0%,與當前主流商用遞送系統如PEI 25K和LNP相當,表明制備的聚合物載體具有優異的核酸包載能力(圖2D)。
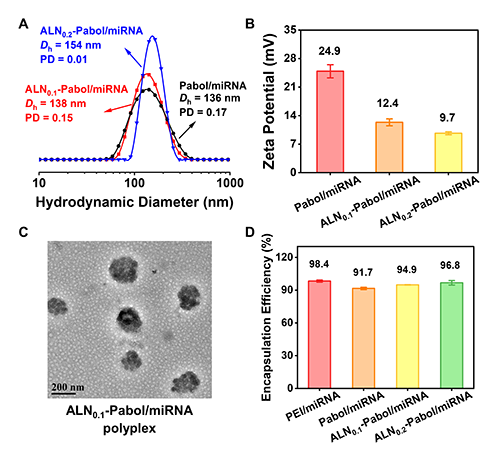
圖2. (A, B) 在最佳滴定條件下形成的各種聚合物/miRNA納米復合物的流體力學直徑 (Dh)、多分散性 (PD) 和zeta電位(ζ)。(C) 用1.0 wt %中性磷鎢酸染色的ALN0.1-Pabol/miRNA復合物的TEM圖像。(D) 不同納米復合物的包封率。
阿侖膦酸(ALN)分子中的膦酸基團可與骨骼羥基磷灰石中的Ca2?離子發生穩定的雙齒螯合作用,賦予其對骨組織的高度親和性。因此,修飾了ALN的ALN-Pabol/miRNA納米復合物能夠與骨組織特異性結合,從而具備出色的骨靶向特性。在體外骨親和性實驗中,ALN接枝率為10.0%的ALN0.1-Pabol與羥基磷灰石粉末的結合率比Pabol高17.1%。進一步比較不同遞送系統后發現,ALN-Pabol/miRNA納米復合物與羥基磷灰石粉末的結合率分別比Pabol/miRNA、PEI/miRNA和Lipo/miRNA高17.6%、31.5%和33.6%(圖3),充分證明其優異的骨組織親和能力。此外,尾靜脈注射48小時后的解剖熒光定量結果也印證了其骨靶向性能。與非靶向的Pabol/miRNA相比,ALN0.1-Pabol/miRNA納米復合物在骨組織部位的熒光信號顯著增強,表明該系統在體內同樣具有高度骨組織富集能力(圖4)。
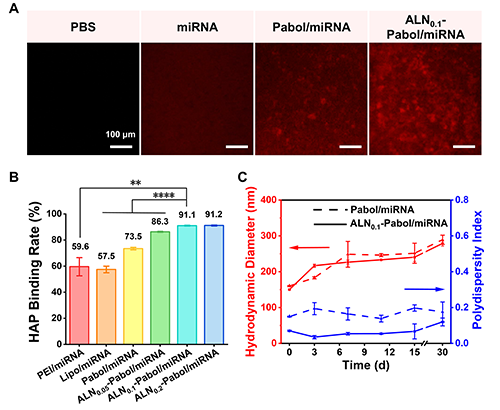
圖3. (A) 吸附在羥基磷灰石片上的ALN0.1-Pabol/miRNA納米復合物的熒光顯微鏡圖像。(B) 各納米復合物與羥基磷灰石粉末的結合能力。(C) Pabol/miRNA和ALN0.1-Pabol/miRNA納米復合物在HEPES緩沖液中4 ℃下儲存30天的流體力學直徑及多分散性隨時間的變化。
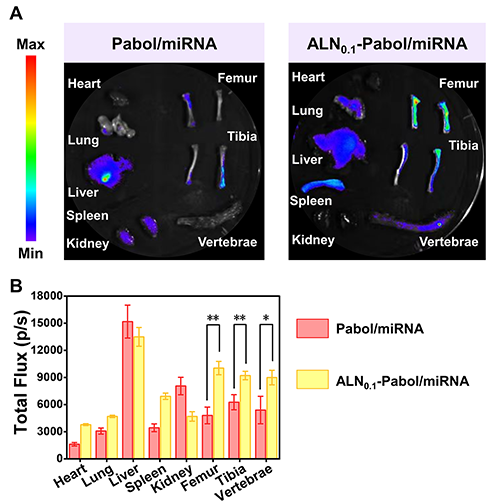
圖4. Pabol/miRNA和ALN0.1-Pabol/miRNA納米復合物的體內生物分布圖像以及各組織中熒光分布強度的定量分析。
鑒于ALN0.1-Pabol/miRNA納米復合物在體內具備良好的骨靶向性能,團隊進一步構建了乳腺癌骨轉移小鼠模型,評估了該遞送系統在骨腫瘤治療中的實際療效。結果如圖5所示,與其他組別相比,ALN0.1-Pabol/miRNA組裸鼠的骨腫瘤重量最小。免疫組化以及免疫熒光結果顯示,該組裸鼠的腫瘤細胞中處于增殖狀態的腫瘤細胞最少,處于凋亡狀態的腫瘤細胞最多。這些結果表明該遞送系統可有效激活抗腫瘤通路,抑制腫瘤細胞生長并誘導其凋亡。

圖5. (A) 乳腺癌骨轉移模型的建立以及治療周期示意圖。(B) 治療完成后荷瘤腿的照片。(C) 不同治療后從荷瘤腿上收集的腫瘤的平均重量。(D, E) 通過 Ki67 染色評估腫瘤細胞治療后的增殖狀態。(F) 通過TUNEL染色評估腫瘤細胞治療后的凋亡狀態。
團隊還通過micro-CT成像技術進一步對ALN0.1-Pabol/miRNA在抑制骨溶解方面的效果進行了深入分析。如圖6所示,PBS組和裸miRNA組小鼠在脛骨部位顯示出了明顯的骨折和骨溶解現象,而經ALN0.1-Pabol/miRNA納米復合物治療后,小鼠脛骨結構明顯更為完整,骨溶解程度顯著降低,骨組織形態與健康對照組幾乎無異,療效遠優于其他處理組。進一步的骨骼結構參數定量分析顯示,經ALN0.1-Pabol/miRNA納米復合物治療后,小鼠骨骼的各項指標(如骨體積、骨密度等)均恢復至接近正常水平,充分證明該遞送系統在抑制骨轉移瘤相關骨破壞方面具有顯著療效。
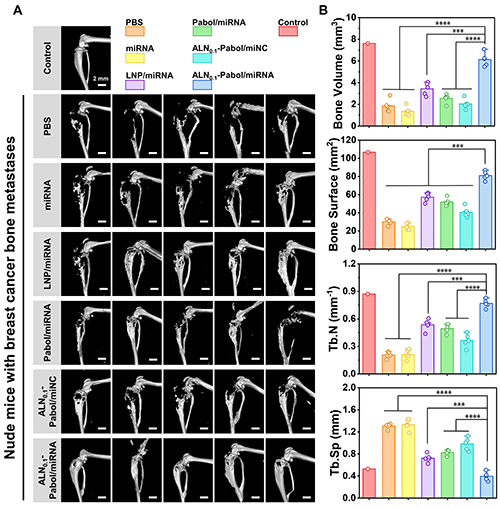
圖6. (A) 不同治療后荷瘤脛骨的micro-CT圖像。(B) 不同治療后小鼠荷瘤脛骨結構參數的定量分析。
綜上所述,團隊構建了一種基于可降解陽離子聚合物和阿侖膦酸(ALN)基團的新型核酸遞送系統——ALN-Pabol,其在體外和體內均表現出優異的骨靶向能力,能夠有效封裝治療性核酸并形成結構穩定的ALN-Pabol/miRNA納米復合物,其在骨組織中實現了精準遞送與局部釋放,顯著提升了對骨轉移瘤的治療效果。ALN的引入不僅顯著增強了納米復合物的骨親和力,而且有效降低了系統性毒性。總之,ALN-Pabol為骨靶向基因治療提供了一種新方法,具有廣泛的適應潛力,有望拓展至骨關節炎、骨質疏松、骨肉瘤等多種骨相關疾病的治療。
該研究成果近期以“Bone-Targeting Nucleic Acid Delivery Polymer Vector for Effective Therapy of Bone Metastasis”為題發表在《ACS Nano》上。同濟大學高分子材料系碩士研究生李澤娟、同濟大學附屬第十人民醫院博士研究生肖霄為論文的共同第一作者,賀石生教授、杜建忠教授和朱云卿研究員為共同通訊作者。該研究得到了國家自然科學基金等資助。
鏈接地址:https://doi.org/10.1021/acsnano.5c04743
- 上海交大傅德皓教授團隊 ACS Nano: 仿生納米囊泡逆轉骨髓內皮細胞分泌表型治療骨質疏松癥 2022-07-13
- 吉林大學杜志陽團隊 ACS Nano:食源性肽程式化共組裝策略及其精準干預結腸炎的效用機制 2025-01-15
- 南華大學魏華/喻翠云團隊ACS Macro Lett.封面:紫外光誘導環狀聚合物載體的環狀-線形拓撲結構變化用于胞內增強藥物遞送 2023-08-16
- 南開大學劉陽團隊 Adv. Mater.: 通過新型聚合物載體控制抗菌肽的空間分布以安全有效地治療癌癥 2022-04-09
- 復旦大學占昌友教授團隊:羥基PEG可規避人群預存抗PEG抗體 - 助力LNP高效遞送 2024-10-30
- 北航常凌乾教授等《Adv. Funct. Mater.》:具有微納電穿孔功能的微通道微針陣列用于實體腫瘤藥物高效遞送 2021-12-16
- 浙江大學高建青教授課題組在干細胞外泌體復合水凝膠局部埋植用于脊髓損傷治療上取得新進展 2020-05-22
